题目内容
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 电解法,反应为2Cu+H2O |
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成__而使Cu2O产率降低。
(2)已知:
①2Cu(s)+ ![]() O2(g)
O2(g)![]() Cu2O(s) ΔH1=-169 kJ·mol-1
Cu2O(s) ΔH1=-169 kJ·mol-1
②C(s)+ ![]() O2(g)
O2(g)![]() CO(g) ΔH2=-110.5 kJ·mol-1
CO(g) ΔH2=-110.5 kJ·mol-1
③Cu(s)+![]() O2(g)
O2(g)![]() CuO(s) ΔH3=-157 kJ·mol-1
CuO(s) ΔH3=-157 kJ·mol-1
则方法a中发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H=________。
(3)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,装置如图所示:
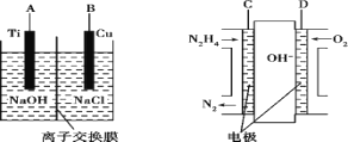
①上述装置中B电极应连_________电极(填“C”或“D”)。
②该离子交换膜为____离子交换膜(填“阴”或“阳”),该电解池的阳极反应式为_______。
③原电池中负极反应式为______________。
(4)在相同体积的恒容密闭容器中,用以上方法制得的两种Cu2O分别进行催化分解水的实验:2H2O(g) ![]() 2H2(g)+O2(g) ΔH>0。水蒸气的浓度随时间t的变化如下表所示:
2H2(g)+O2(g) ΔH>0。水蒸气的浓度随时间t的变化如下表所示:
序号 | 温度/℃c/mol·L-1t/min | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.049 2 | 0.048 6 | 0.048 2 | 0.048 0 | 0.048 0 |
② | T1 | 0.050 | 0.048 8 | 0.048 4 | 0.048 0 | 0.048 0 | 0.048 0 |
③ | T2 | 0.10 | 0.096 | 0.093 | 0.090 | 0.090 | 0.090 |
①催化剂的催化效率:实验①_______实验②(填“>”或“<”)。
②实验①、②、③的化学平衡常数K1、K2、K3的大小关系为________。
【答案】 Cu +34.5kJ·mol-1 D 阴 2Cu-2e-+2OH-![]() Cu2O+H2O N2H4-4e-+4OH-
Cu2O+H2O N2H4-4e-+4OH-![]() N2↑+4H2O < K1=K2<K3
N2↑+4H2O < K1=K2<K3
【解析】(1)用炭粉在高温条件下还原CuO容易生成Cu,反应不易控制生成Cu2O,故答案为:反应不易控制,易还原产生Cu而使Cu2O产率降低;(2)已知:①2Cu(s)+![]() O2(g)=Cu2O(s)△H=-169kJ/mol,②C(s)+
O2(g)=Cu2O(s)△H=-169kJ/mol,②C(s)+![]() O2(g)=CO(g)△H=-110.5kJ/mol,③Cu(s)+
O2(g)=CO(g)△H=-110.5kJ/mol,③Cu(s)+![]() O2(g)═CuO(s)△H=-157kJ/mol;用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为C(s)+2CuO (s)=Cu2O(s)+CO(g),该反应可以是②-③×2-
O2(g)═CuO(s)△H=-157kJ/mol;用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为C(s)+2CuO (s)=Cu2O(s)+CO(g),该反应可以是②-③×2-![]() ×①,反应的焓变是-110.5kJ/mol-(-157kJ/mol×2)-
×①,反应的焓变是-110.5kJ/mol-(-157kJ/mol×2)-![]() ×(-169kJ/mol)=+34.5kJ/mol;(3)①该电解池的阳极发生氧化反应,所以Cu失去电子,与氢氧根离子结合生成氧化亚铜和水,故铜为阳极,燃料电池中通入氧气一极D极氧气得电子产生氢氧根离子,故上述装置中B电极应连D电极;②该离子交换膜为阴离子交换膜,电极反应式是2Cu-2e-+2OH-= Cu2O+H2O;③原电池中负极碱性条件下N2H4失电子产生氮气,电极反应式为N2H4-4e-+4OH-
×(-169kJ/mol)=+34.5kJ/mol;(3)①该电解池的阳极发生氧化反应,所以Cu失去电子,与氢氧根离子结合生成氧化亚铜和水,故铜为阳极,燃料电池中通入氧气一极D极氧气得电子产生氢氧根离子,故上述装置中B电极应连D电极;②该离子交换膜为阴离子交换膜,电极反应式是2Cu-2e-+2OH-= Cu2O+H2O;③原电池中负极碱性条件下N2H4失电子产生氮气,电极反应式为N2H4-4e-+4OH-![]() N2↑+4H2O;(4)①根据表中数据可知,实验②先达到平衡,催化剂的催化效率:实验①<实验②;②温度相同K值相同,则K1=K2,从表中数据可知实验③的水蒸气转化率低,故K3较小,则实验①、②、③的化学平衡常数K1、K2、K3的大小关系为K1=K2<K3。
N2↑+4H2O;(4)①根据表中数据可知,实验②先达到平衡,催化剂的催化效率:实验①<实验②;②温度相同K值相同,则K1=K2,从表中数据可知实验③的水蒸气转化率低,故K3较小,则实验①、②、③的化学平衡常数K1、K2、K3的大小关系为K1=K2<K3。

 名校课堂系列答案
名校课堂系列答案