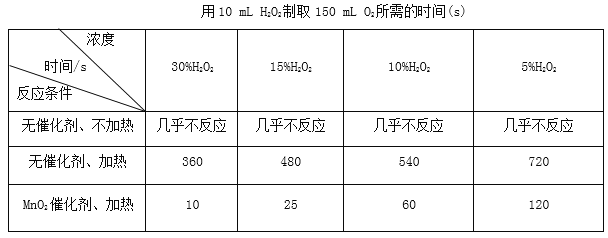
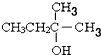ĢāÄæÄŚČŻ
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
A.ÓĆĻµĶ³ĆüĆū·ØĆüĆūÓŠ»śĪļ 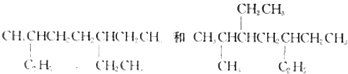 Ö÷Į“Ģ¼Ō×ÓŹż¾łĪŖ7øö
Ö÷Į“Ģ¼Ō×ÓŹż¾łĪŖ7øö
B.ijĢžµÄ·Ö×ÓŹ½ĪŖC10H14 £¬ Ėü²»ÄÜŹ¹äåĖ®ĶŹÉ«£¬µ«æÉŹ¹ĖįŠŌKMnO4ČÜŅŗĶŹÉ«£¬ĒŅ·Ö×Ó½į¹¹ÖŠÖ»ÓŠŅ»øöĶ黳£¬·ūŗĻĢõ¼žµÄĢžÓŠ4ÖÖ
C.Ģ¼Ō×ÓŹżŠ”ÓŚ»ņµČÓŚ8µÄµ„Ļ©ĢžÖŠ£¬ÓėHBr¼Ó³É²śĪļÖ»ÓŠŅ»ÖÖ½į¹¹£¬·ūŗĻĢõ¼žµÄµ„Ļ©ĢžÓŠ6ÖÖ
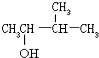
D.¾²ā¶ØC3H7OHŗĶC6H12×é³ÉµÄ»ģŗĻĪļÖŠŃõµÄÖŹĮæ·ÖŹżĪŖ8%£¬Ōņ“Ė»ģŗĻĪļÖŠĢ¼µÄÖŹĮæ·ÖŹżŹĒ78%
”¾“š°ø”æD
”¾½āĪö”æA£® 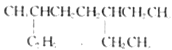 Ö÷Į“ÉĻÓŠ8øöĢ¼Ō×Ó£¬A²»·ūŗĻĢāŅā£»
Ö÷Į“ÉĻÓŠ8øöĢ¼Ō×Ó£¬A²»·ūŗĻĢāŅā£»
B£®øĆĢžµÄ·Ö×ÓŹ½·ūŗĻ2n©6µÄĶØŹ½£¬Ėü²»ÄÜŹ¹äåĖ®ĶŹÉ«£¬µ«æÉŹ¹KMnO4ĖįŠŌČÜŅŗĶŹÉ«£¬ĖłŅŌŗ¬ÓŠ±½»·£»øł¾ŻĢāŅāÖŖ£¬øĆ·Ö×Óŗ¬ÓŠ¶”ĶéĶ黳£¬ĖłŅŌֻŊ¶Ļ¶”ĶéĶ黳µÄĶ¬·ÖŅģ¹¹Ģ弓æÉ£»¶”ĶéĶ黳µÄĢ¼Į“Ķ¬·ÖŅģ¹¹ĢåÓŠ 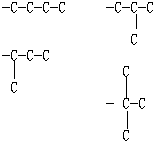 £¬±½µÄĶ¬ĻµĪļÖŠÓė±½»·ĻąĮ¬µÄCŌ×ÓÉĻ±ŲŠėŗ¬ÓŠHŌ×Ó£¬²Åæɱ»ĖįŠŌøßĆĢĖį¼ŲŃõ»Æ£¬Ź¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«£¬Ķ黳
£¬±½µÄĶ¬ĻµĪļÖŠÓė±½»·ĻąĮ¬µÄCŌ×ÓÉĻ±ŲŠėŗ¬ÓŠHŌ×Ó£¬²Åæɱ»ĖįŠŌøßĆĢĖį¼ŲŃõ»Æ£¬Ź¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«£¬Ķ黳 ![]() £¬Óė±½»·ĻąĮ¬µÄCŌ×ÓÉĻ²»ŗ¬HŌ×Ó£¬²»ÄÜŹ¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«£¬·ūŗĻĢõ¼žµÄĢžÓŠ3ÖÖ£¬B²»·ūŗĻĢāŅā£»
£¬Óė±½»·ĻąĮ¬µÄCŌ×ÓÉĻ²»ŗ¬HŌ×Ó£¬²»ÄÜŹ¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«£¬·ūŗĻĢõ¼žµÄĢžÓŠ3ÖÖ£¬B²»·ūŗĻĢāŅā£»
C£®·ūŗĻĢõ¼žµÄµ„Ļ©ĢžÓŠ4ÖÖ£¬Ģ¼Ō×ÓŹżŠ”ÓŚ8µÄµ„Ļ©ĢžÓėHBr·¢Éś¼Ó³É·“Ó¦Ö»µĆŅ»ÖÖ²śĪļ£¬ĖµĆ÷øƵ„Ļ©ĢžŹĒŅŌĢ¼Ģ¼Ė«¼üĪŖÖŠŠÄµÄ¶Ō³Ę½į¹¹£¬·ūŗĻÕāŅ»Ģõ¼žµÄÓŠ£ŗCH2ØTCH2£¬CH3©CHØTCH©CH3”¢CH3©CH2©CHØTCH©CH2©CH3”¢ 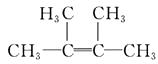 ”¢CH3CH2CH2CHØTCHCH2CH2CH3”¢£ØCH3£©2CHCHØTCHCH£ØCH3£©2”¢CH3CH2C£ØCH3£©ØTC£ØCH3£©CH2CH3£¬¹²ĘßÖÖ£¬C²»·ūŗĻĢāŅā£»
”¢CH3CH2CH2CHØTCHCH2CH2CH3”¢£ØCH3£©2CHCHØTCHCH£ØCH3£©2”¢CH3CH2C£ØCH3£©ØTC£ØCH3£©CH2CH3£¬¹²ĘßÖÖ£¬C²»·ūŗĻĢāŅā£»
D£®C3H7OHÖŠOµÄÖŹĮæ·ÖŹżĪŖ ![]() £®
£®
ĖłŅŌ»ģŗĻĪļÖŠC3H7OHÖŹĮæ·ÖŹżĪŖ ![]() =30%£¬ĖłŅŌ»ģŗĻĪļÖŠC6H12µÄÖŹĮæ·ÖŹżĪŖ1©30%=70%£¬
=30%£¬ĖłŅŌ»ģŗĻĪļÖŠC6H12µÄÖŹĮæ·ÖŹżĪŖ1©30%=70%£¬
»ģŗĻĪļÖŠC3H7OHŗ¬HŌŖĖŲŌŚ»ģŗĻĪļÖŠµÄÖŹĮæ·ÖŹżĪŖ ![]() ”Į30%=4%£¬
”Į30%=4%£¬
»ģŗĻĪļÖŠC6H12ŗ¬HŌŖĖŲŌŚ»ģŗĻĪļÖŠµÄÖŹĮæ·ÖŹżĪŖ ![]() ”Į70%=10%£¬
”Į70%=10%£¬
ĖłŅŌ»ģŗĻĪļÖŠĒāµÄÖŹĮæ·ÖŹżĪŖH%=4%+10%=14%£¬»ģŗĻĪļÖŠCµÄÖŹĮæ·ÖŹżĪŖ1©14%©8%=78%£¬D·ūŗĻĢāŅā£®
ĖłŅŌ“š°øŹĒ£ŗD£®

”¾ĢāÄæ”æÄÉĆ×¼¶Cu2OÓÉÓŚ¾ßÓŠÓÅĮ¼µÄ“߻ƊŌÄܶųŹÜµ½¹Ų×¢£¬ĻĀ±ķĪŖÖĘČ”Cu2OµÄĮ½ÖÖ·½·Ø£ŗ
·½·Øa | ÓĆĢæ·ŪŌŚøßĪĀĢõ¼žĻĀ»¹ŌCuO |
·½·Øb | µē½ā·Ø£¬·“Ó¦ĪŖ2Cu+H2O |
£Ø1£©¹¤ŅµÉĻ³£ÓĆ·½·ØbÖĘČ”Cu2O¶ųŗÜÉŁÓĆ·½·Øa£¬ĘäŌŅņŹĒ·“Ó¦Ģõ¼ž²»Ņ×æŲÖĘ£¬ČōæŲĪĀ²»µ±Ņ×Éś³É__¶ųŹ¹Cu2O²śĀŹ½µµĶ”£
£Ø2£©ŅŃÖŖ£ŗ
¢Ł2Cu(s)+ ![]() O2(g)
O2(g)![]() Cu2O(s) ¦¤H1=£169 kJ”¤mol£1
Cu2O(s) ¦¤H1=£169 kJ”¤mol£1
¢ŚC(s)+ ![]() O2(g)
O2(g)![]() CO(g) ¦¤H2=£110.5 kJ”¤mol£1
CO(g) ¦¤H2=£110.5 kJ”¤mol£1
¢ŪCu(s)+![]() O2(g)
O2(g)![]() CuO(s) ¦¤H3=£157 kJ”¤mol£1
CuO(s) ¦¤H3=£157 kJ”¤mol£1
Ōņ·½·ØaÖŠ·¢ÉśµÄ·“Ó¦£ŗ2CuO(s)£«C(s)= Cu2O(s)£«CO(g)£»”÷H=________”£
£Ø3£©·½·ØbŹĒÓĆėĀČ¼ĮĻµē³ŲĪŖµēŌ“£¬ĶعżĄė×Ó½»»»Ä¤µē½ā·ØæŲÖʵē½āŅŗÖŠOH£µÄÅØ¶ČĄ“ÖʱøÄÉĆ×Cu2O£¬×°ÖĆČēĶ¼ĖłŹ¾£ŗ
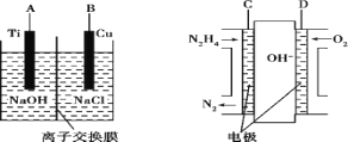
¢ŁÉĻŹö×°ÖĆÖŠBµē¼«Ó¦Į¬_________µē¼«(Ģī”°C”±»ņ”°D”±)”£
¢ŚøĆĄė×Ó½»»»Ä¤ĪŖ____Ąė×Ó½»»»Ä¤(Ģī”°Ņõ”±»ņ”°Ńō”±)£¬øƵē½ā³ŲµÄŃō¼«·“Ó¦Ź½ĪŖ_______”£
¢ŪŌµē³ŲÖŠøŗ¼«·“Ó¦Ź½ĪŖ______________”£
£Ø4£©ŌŚĻąĶ¬Ģå»żµÄŗćČŻĆܱÕČŻĘ÷ÖŠ£¬ÓĆŅŌÉĻ·½·ØÖʵƵÄĮ½ÖÖCu2O·Ö±š½ųŠŠ“߻ƷֽāĖ®µÄŹµŃé£ŗ2H2O(g) ![]() 2H2(g)+O2(g) ¦¤H>0”£Ė®ÕōĘųµÄÅضČĖꏱ¼ätµÄ±ä»ÆČēĻĀ±ķĖłŹ¾£ŗ
2H2(g)+O2(g) ¦¤H>0”£Ė®ÕōĘųµÄÅضČĖꏱ¼ätµÄ±ä»ÆČēĻĀ±ķĖłŹ¾£ŗ
ŠņŗÅ | ĪĀ¶Č/”ęc/mol”¤L-1t/min | 0 | 10 | 20 | 30 | 40 | 50 |
¢Ł | T1 | 0.050 | 0.049 2 | 0.048 6 | 0.048 2 | 0.048 0 | 0.048 0 |
¢Ś | T1 | 0.050 | 0.048 8 | 0.048 4 | 0.048 0 | 0.048 0 | 0.048 0 |
¢Ū | T2 | 0.10 | 0.096 | 0.093 | 0.090 | 0.090 | 0.090 |
¢Ł“߻ƼĮµÄ“߻Ɗ§ĀŹ:ŹµŃé¢Ł_______ŹµŃé¢Ś(Ģī”°>”±»ņ”°<”±)”£
¢ŚŹµŃé¢Ł”¢¢Ś”¢¢ŪµÄ»ÆŃ§Ę½ŗā³£ŹżK1”¢K2”¢K3µÄ“󊔹ŲĻµĪŖ________”£
”¾ĢāÄæ”æ»īŠŌĢææÉ“¦Ąķ“óĘųĪŪČ¾ĪļNO”£T”ꏱ£¬ŌŚ1LĆܱÕČŻĘ÷ÖŠ¼ÓČėNOĘųĢåŗĶĢæ·Ū£¬·¢Éś·“Ӧɜ³ÉĮ½ÖÖĘųĢåAŗĶB£¬²āµĆø÷ĪļÖŹµÄĪļÖŹµÄĮæČēĻĀ£ŗ
»īŠŌĢæ/mol | NO/mol | A/mol | B/mol | |
ĘšŹ¼×“Ģ¬ | 2.030 | 0.100 | 0 | 0 |
2 minŹ± | 2.000 | 0.040 | 0.030 | 0.030 |
£Ø1£©2 minÄŚ£¬ÓĆNO±ķŹ¾øĆ·“Ó¦µÄĘ½¾łĖŁĀŹv(NO)£½ mol”¤L-1”¤min-1£»
£Ø2£©øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ________________________________________£»
£Ø3£©Ņ»¶ØĢõ¼žĻĀ£¬ŌŚĆܱÕŗćČŻµÄČŻĘ÷ÖŠ£¬ÄܱķŹ¾ÉĻŹö·“Ó¦“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŹĒ_____ ”£
¢Łv(NO)”Ćv(A)”Ćv(B)=2”Ć1”Ć1
¢Ś»ģŗĻĘųĢåµÄĆÜ¶Č²»ŌŁøıä
¢Ū×ÜŃ¹Ēæ²»ŌŁøıä
¢Ü»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»ŌŁøıä
£Ø4£©Ģ¼ŌŖĖŲæÉŠĪ³ÉŹżĮæÖŚ¶ą£¬·Ö²¼¼«¹ćµÄÓŠ»ś»ÆŗĻĪļ£¬ĘäÖŠ¼×“¼ŹĒ³£¼ūµÄČ¼ĮĻ£¬¼×“¼Č¼ĮĻµē³ŲµÄ½į¹¹Ź¾ŅāĶ¼ČēĻĀ£¬Ņ»¼«ĶØČė¼×“¼£¬ĮķĶāŅ»¼«ĶØČėŃõĘų£»µē½āÖŹČÜŅŗŹĒĻ”ĮņĖį£¬µē³Ų¹¤×÷Ź±×Ü·“Ó¦Ź½£ŗ2CH3OH£«3O2£½2CO2£«4H2O”£
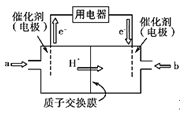
¢Ła“¦ĶØČėµÄĪļÖŹŹĒ____£¬µē¼«·“Ó¦Ź½ĪŖ£ŗ______£»
¢Śb“¦µē¼«·“Ó¦Ź½ĪŖ_________________________£»
¢Ūµē³Ų¹¤×÷Ź±H£«ÓÉ ¼«ŅĘĻņ ¼«£ØĢīÕż”¢øŗ¼«£©”£