题目内容
取NaOH溶液50mL,通入一定量CO2,再向溶液中逐滴加入0.1mol/L盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列说法错误的是
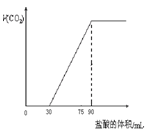

| A.原NaOH溶液中通入CO2后,所得溶液中c(CO32-)小于C(HCO3-) |
| B.NaOH溶液中,Na+的物质的量浓度为0.18 mol/L |
| C.NaOH溶液中通入CO2后,再加入足量盐酸产生CO2气体体积(标准状况)1344mL。 |
| D.0—30mL之间的离子方程式:CO32-+H+→HCO3- |
A
分析:由图可知,0~30mL没有气体生成,从30mL开始加盐酸生成二氧化碳气体,共消耗盐酸90mL-30mL=60mL,则NaOH溶液50mL,通入一定量CO2反应后溶液中的溶质为Na2CO3、NaHCO3,且二者的量相同,然后利用盐酸的物质的量来计算Na+的物质的量浓度及二氧化碳气体的体积.
解:因0~30mL没有气体生成,从30mL开始加盐酸生成二氧化碳气体,共消耗盐酸90mL-30mL=60mL,两个过程消耗的酸的体积比为1:2,
则NaOH溶液通入一定量CO2反应后溶液中的溶质为等物质的量的Na2CO3、NaHCO3,
A、等物质的量的Na2CO3、NaHCO3,则所得溶液中c(CO32-)=c(HCO3-),故A错误;
B、由HCl~NaCl~NaOH,则NaOH的物质的量为0.09L×0.1mol/L=0.009mol,Na+的物质的量浓度为
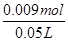 =0.18mol/L,故B正确;
=0.18mol/L,故B正确;C、等物质的量的Na2CO3、NaHCO3,其物质的量为
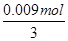 =0.003mol,由碳原子守恒可知二氧化碳的物质的量为0.003mol×2=0.006mol,则加入足量盐酸产生CO2气体体积在标准状况下为0.006mol×22.4L/mol=1344mL,故C正确;
=0.003mol,由碳原子守恒可知二氧化碳的物质的量为0.003mol×2=0.006mol,则加入足量盐酸产生CO2气体体积在标准状况下为0.006mol×22.4L/mol=1344mL,故C正确;D、0~30mL,发生碳酸钠与盐酸反应生成碳酸氢钠和氯化钠,其离子方程式为CO32-+H+═HCO3-,故D正确;
故选A.

练习册系列答案
相关题目

 HCO3-+OH-。下列说法正确的是
HCO3-+OH-。下列说法正确的是