题目内容
【题目】H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂。有研究表明,H2O2溶液的漂白性是HO2—所致。
(1)H2O2溶液显弱酸性,测得0.15 mol·L1 H2O2溶液pH约为6。写出H2O2生成HO2—的电离方程式:。
(2)其他条件相同时,研究不同初始pH条件下H2O2溶液的漂白效果,结果如下: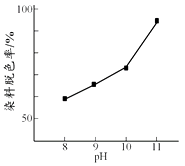
由上图可得到的结论是 , 结合平衡移动原理简述理由:。
(3)实验发现: 若pH >11,则H2O2溶液的漂白效果随pH增大而降低。针对这一现象,继续进行实验,发现溶液中H2O2的分解与pH有关。测定不同初始pH条件下,初始浓度均为0.15 mol·L1 的H2O2溶液发生分解反应,结果如下:
初始pH | pH = 10 | pH = 12 |
1小时后H2O2溶液浓度 | 0.13 mol·L1 | 0.07 mol·L1 |
1小时后pH | 没有明显变化 | 没有明显变化 |
查阅资料:HO2-+H2O2=H2O+O2+OH-。
①结合离子方程式解释1小时后pH没有明显变化的原因:。
②从反应速率的角度分析pH过大,H2O2溶液漂白效果会降低的原因:。
【答案】
(1)H2O2 ![]() HO2-+ H+
HO2-+ H+
(2)其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好,c(OH-)增大,促使H2O2 ![]() HO2-+ H+正向移动,c(HO2-)增大,漂白效果越好
HO2-+ H+正向移动,c(HO2-)增大,漂白效果越好
(3)碱性条件下:H2O2 + OH-= HO2-+ H2O,又知HO2-+ H2O2 = H2O+ O2 + OH-,OH-可看作是H2O2分解反应的催化剂,故反应前后pH不变,pH过大,H2O2分解过快,使参与漂白的c(HO2-)下降,故漂白效果降低;
【解析】解:(1)H2O2生成HO2—的电离方程式为H2O2 ![]() HO2-+ H+,
HO2-+ H+,
故答案为:H2O2 ![]() HO2-+ H+;
HO2-+ H+;
(2)根据图像可知,其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好;因为c(OH-)增大,促使H2O2 ![]() HO2-+ H+正向移动,c(HO2-)增大,漂白效果越好,
HO2-+ H+正向移动,c(HO2-)增大,漂白效果越好,
故答案为:其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好;c(OH-)增大,促使H2O2 ![]() HO2-+ H+正向移动,c(HO2-)增大,漂白效果越好;
HO2-+ H+正向移动,c(HO2-)增大,漂白效果越好;
(3)①碱性条件下:H2O2 + OH-= HO2-+ H2O,又知HO2-+ H2O2 = H2O+ O2 + OH-,OH-可看作是H2O2分解反应的催化剂,故反应前后pH不变,
故答案为:碱性条件下:H2O2 + OH-= HO2-+ H2O,又知HO2-+ H2O2 = H2O+ O2 + OH-,OH-可看作是H2O2分解反应的催化剂,故反应前后pH不变;
②pH过大,H2O2分解过快,使参与漂白的c(HO2-)下降,故漂白效果降低,
故答案为:pH过大,H2O2分解过快,使参与漂白的c(HO2-)下降,故漂白效果降低。
(1)根据弱电解质的电离书写电离方程式;
(2)根据化学平衡移动的影响因素进行分析;
(3)根据溶液中氢氧根离子的作用进行分析即可.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应的措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g甲醇(CH3OH,液态)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式: .
(2)已知化学键的键能为:
化学键 | H﹣H | N﹣H | N≡N |
键能/kJmol﹣1 | 436 | 391 | 945 |
又知反应N2(g)+3H2(g)2NH3(g)△H=a kJmol﹣1 . 试根据表中所列键能数据估算a的值为 .
(3)已知:C(s,石墨)+O2(g)═CO2(g)△H=﹣393kJmol﹣1
2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJmol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2599kJmol﹣1
根据盖斯定律,计算 298K时C(s,石墨)和H2(g)反应生成1mol C2H2(g)的焓变为 .
【题目】下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
实验 | 金属 | 金属 | c(H2SO4) mol/L | 实验 | 金属消失 | |
1 | 0.10 | 丝 | 0.7 | 20 | 250 | |
2 | 0.10 | 丝 | 1.0 | 20 | 200 | |
3 | 0.10 | 粉末 | 1.0 | 20 | 125 | |
4 | 0.10 | 粉末 | 1.0 | 30 | 50 |
分析上述数据,回答下列问题:
(1)反应的离子方程式:;
(2)①实验1、2可得出的结论是,硫酸浓度越 , 反应速率越慢;
②实验2、3可得出的结论是反应物接触面越大,反应速率越;
③实验3、4可得出的结论是温度越 , 反应速率越快.
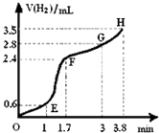
(3)①用铁粉和稀硫酸反应制取H2 , 实验过程中绘制出生成H2的体积(V)与时间(t)的关系如图所示. 试分析判断OE段、EF段、FG段、GH段反应速率(分别用v (OE)、v (EF)、v (FG)、v (GH)表示)最快时段是 .
A.v (OE) B.v (EF)
C.v (FG) D.v (GH)
②1min内反应较慢的原因是:;一段时间后反应明显加快的原因是 .