题目内容
氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,反应的化学方程式为:
8HClO3 → 3O2↑+ 2Cl2↑+ 4HClO4 + 2H2O。
(1)在上述变化过程中,发生还原反应的过程是:_________→___________(填化学式)。
该反应的氧化产物是____________(填化学式);所得混合气体的平均式量为_______。
(2)已知测定锰的一种方法是:将锰离子转化为高锰酸根离子。反应体系中有H+、Mn2+、H2O、IO3—、MnO4—、IO4—离子,该离子反应方程式为____________________________。若将该反应设计成原电池,则在正极生成的离子是___________(填离子名称)
(3)综合上述各反应及已有知识,可推知氧化性强弱关系正确的是_________(填序号)。
a. KMnO4> Cl2 b. Cl2> O2 c. HIO4> HClO3 d. HIO4> Cl2
(本题共8分)(1)HClO3 → Cl2(1分); O2 HClO4(1分) 47.6 (1分)
(2)2Mn2+ + 5IO4— + 3H2O → 2MnO4— + 5IO3— + 6H+(2分);碘酸根离子(1分)(3)a、d(2分)
解析试题分析:(1)根据方程式可知,氯酸钾中氯元素的化合价由+5价部分降低到0价,得到电子,被还原。部分升高到+7价,失去电子,被氧化。另外氧元素的化合价从-2价升高到0价,失去电子,被氧化,所以发生还原反应的过程可表示为HClO3 → Cl2,其中氧化产物是O2和HClO4。所得混合气体是氧气和氯气,二者的体积之比是3:2,所以混合气的平均式量为(3×32+2×71)÷5=47.6。
(2)由于将锰离子转化为高锰酸根离子,所以锰离子是还原剂失去电子,因此IO4—是氧化剂,其还原产物是IO3—,所以该离子反应方程式为2Mn2+ + 5IO4— + 3H2O → 2MnO4— + 5IO3— + 6H+。原电池中正极得到电子,发生还原反应,所以根据离子方程式可知,在正极发生反应的离子是IO4—,而生成的离子是IO3—。
(3)在氧化还原反应中氧化剂的氧化性强于氧化产物,因此根据反应的方程式可知,氧化性应该是HIO4>KMnO4>Cl2,答案选ad。
考点:考查氧化还原反应的有关判断、应用、计算以及电极产物的判断等

下列离子方程式表示正确的是( )
| A.AgNO3溶液中加入Cu:Cu + Ag+ = Cu2+ + Ag |
| B.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42—+Ba2++OH—=BaSO4↓+H2O |
| C.甲酸溶液滴到大理石台板上有气泡产生:2H+ + CaCO3 = CO2↑+ Ca2+ + H2O |
| D.等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合: |
某硝石(主要成分是NaNO3)除去不溶性杂质后,其溶液中还含有NaCl、Ca(HCO3)2,实验室提纯NaNO3溶液时,往溶液中依次加入过量的NaOH、AgNO3、Na2CO3,过滤后再加入适量硝酸。以上过程发生5个离子反应,以下4个离子方程式中不符合反应事实的是
| A.Ca2++HCO3-+OH-→ CaCO3↓+H2O | B.Ag++OH-→AgOH↓ |
| C.2Ag++CO32-→Ag2CO3↓ | D.CO32-+2H+→ CO2↑+H2O |
向Na2CO3溶液中逐滴加入水杨酸(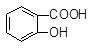 )溶液,可能发生的反应的离子方程式且书写正确的是
)溶液,可能发生的反应的离子方程式且书写正确的是
A.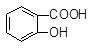 +CO32―→ +CO32―→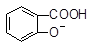 +HCO3― +HCO3― |
B.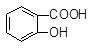 +CO32―→ +CO32―→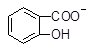 +HCO3― +HCO3― |
C.2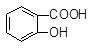 +CO32―→2 +CO32―→2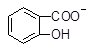 +CO2↑ +CO2↑ |
D.3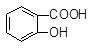 +2CO32―→3 +2CO32―→3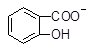 +HCO3―+H2O+CO2↑ +HCO3―+H2O+CO2↑ |
下列关于离子检验的说法中,正确的是
| A.向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液中一定含有C1- |
| B.向某溶液中加入稀盐酸,产生无色气体,则该溶液中一定含有CO32- |
| C.向某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,该溶液中一定含有SO42- |
| D.向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ |
根据下表提供的数据可知能大量共存的微粒组是
| 化学式 | 电离常数(25℃) |
| CH3COOH | Ki =1.7×10-5 |
| HClO | Ki =3.0×10-8 |
| H2CO3 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
A.H2CO3、HCO3-、CH3COO-、ClO-
B.HClO、 HCO3-、CH3COO-、ClO-
C.HClO 、HCO3-、ClO-、CO32-
D.HCO3-、CH3COO-、ClO-、CO32-
在由水电离产生的H+的浓度为1×10-13 mol/L的溶液中,一定能大量共存的离子组是
①K+、Cl-、NO3-、S2-;②K+、Fe2+、I-、SO42-;③Na+、Cl-、NO3-、SO42-;④Na+、Ca2+、Cl-、HCO3-;⑤K+、Ba2+、Cl-、NO3-
| A.①③ | B.③⑤ | C.③④ | D.②⑤ |
下列离子方程式正确的是( )
| A.Fe与盐酸反应制H2:2Fe+6H+=2Fe3++3H2↑ |
B.用石墨电极电解饱和食盐水:2H++2Cl—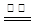 Cl2↑+H2↑ Cl2↑+H2↑ |
| C.用AlCl3和氨水制备Al(OH)3:Al3++3OH-=Al(OH)3↓ |
D.向Mg(OH)2浊液中滴入FeCl3溶液:3Mg(OH)2(s)+2Fe3+ 2Fe(OH)3(s)+3Mg2+ 2Fe(OH)3(s)+3Mg2+ |
下列各组溶液中,可能大量共存的离子组有
| A.加入Al粉后反应产生H2的溶液中:NH4+、Na+、SiO32-、HCO3- |
| B.滴加甲基橙试液后呈红色的溶液中: Na+、 CO32-、 K+、 AlO2- |
| C.水电离产生的c(OH-)=1×11-11mol/L的溶液中:Al3+、SO42-、NO3-、Cl- |
| D.含有大量I—的溶液中:K+、Mg2+、ClO-、SO42- |