题目内容
下列比较或归纳正确的是( )
| A.稳定性:NH3<PH3<ASH3 |
| B.离子半径:Cl->S2->Al3+ |
| C.酸性:HClO4>H2SO4>H3PO4 |
| D.碱性:Be(OH)2>Mg(OH)2>Al(OH)3 |
C
解析试题分析:A选项稳定性的比较主要看原子半径的大小,半径越小,越稳定,所以最稳定的是氨气,最不稳定的是ASH3 故A选项是错误的。B选项半径的比较,电子层数越多,半径越大,电子层数相同时原子序数越大,半径越小所以S2应大于Cl- D选项半径越大,碱性越强,所以氢氧化镁的碱性最强故D选项是错误的
考点:考查元素周期律的相关应用

下列有关说法不正确的是( )
| A.C3H8中碳原子都采用的是sp3杂化 |
| B.O2、CO2、N2都是非极性分子 |
| C.酸性:H2CO3<H3PO4<H2SO4<HClO |
D.CO的一种等电子体为NO+,它的电子式为 |
X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子。下列有关这些元素性质的说法一定正确的是
| A.X元素的氢化物的水溶液显碱性 |
| B.Z元素的单质在一定条件下能与X元素的单质反应 |
| C.Z元素的离子半径大于W元素的离子半径 |
| D.Y元素最高价氧化物的晶体具有很高的熔点和沸点 |
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是( ) 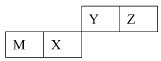
| | Y | Z | |
| M | X | | |
B.Y的最高价氧化物对应水化物的酸性比X 的弱
C.X 的最简单气态氢化物的热稳定性比Z的小
D.Z位于元素周期表中第2 周期、第ⅥA族
1919年,科学家第一次实现了人类多年的梦想——人工转变元素。这个核反应如下: N+
N+ He―→
He―→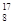 O+
O+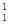 H,下列叙述正确的是( )
H,下列叙述正确的是( )
A.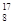 O原子核内有9个质子 O原子核内有9个质子 |
B.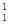 H原子核内有1个中子 H原子核内有1个中子 |
| C.O2和O3互为同位素 |
| D.通常情况下,He和N2化学性质都很稳定 |
四种主族元素的离子a Xm+,bYn+,cZn-和dRm-(a,b,c,d为元素的原子序数),它们具有相同的电子层结构,若m>n,对下列叙述的判断正确的是( )
①a-b=n-m ②元素的原子序数a>b>c>d
③元素非金属性Z>R ④最高价氧化物对应水化物碱性X>Y
| A.②③正确 | B.只有③正确 | C.①②③④正确 | D.①②③正确 |
两种微粒含有相同的质子数和电子数,这两种微粒的关系可能是:(1)同一元素的不同原子,(2)不同元素的原子,(3)两种不同的分子,(4)一种原子和一种分子,(5)一种原子和一种离子,(6)一种分子和一种离子,(7)两种不同的阳离子,(8)两种不同的阴离子,(9)一种阴离子和一种阳离子,其中正确的是
| A.(1)(3)(4)(7)(8) | B.(1)(2)(5)(7)(9) |
| C.(1)(2)(5)(7)(9) | D.(1)(2)(3)(4)(5) |
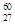 Co是r射线的放射源,关于
Co是r射线的放射源,关于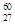 27Co的说法正确的是
27Co的说法正确的是
| A.质子数为 33 | B.中子数为27 | C.质量数为60 | D.核电荷数为60 |