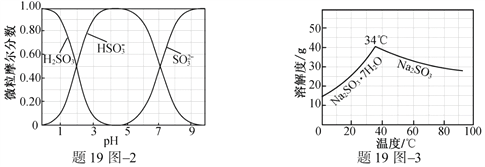
题目内容
【题目】氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3═bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法不正确的是
A.由反应可推断氧化性:HClO4<HClO3
B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:5Cl2+I2+6H2O═12H++10Cl-+2IO3-
C.若氯酸分解所得混合气体,1 mol混合气体质量为47.6 g,则反应方程式可表示为26HClO3 ═15O2↑+8Cl2↑+10HClO4+8H2O
D.若化学计量数a=8,b=3,则该反应转移电子数为20e-
【答案】C
【解析】
A.aHClO3═bO2↑+cCl2↑+dHClO4+eH2O反应中HClO3既是氧化剂又是还原剂,其中Cl由+5价升高到+7价,O由-2价升高到0价,因此HClO4、O2是氧化产物;其中Cl由+5价降低到0价,因此Cl2是还原产物,氧化剂的氧化性强于氧化产物,则氧化性HClO4<HClO3,故A正确;
B.淀粉碘化钾试纸先变蓝是因为生成I2:2I-+Cl2=I2+2Cl-,后褪色I2被Cl2继续氧化生成IO3-:5C12+I2+6H2O=12H++10Cl-+2IO3-,遵循电子、电荷守恒,故B正确;
C.由生成的Cl2和O2的混合气体平均分子量为47.6g/mol,则![]() ,可得n(Cl2)∶n(O2)=2∶3,由电子守恒得化学反应方程式为:8 HClO3=3O2↑+2 Cl2↑+4 HClO4+2H2O,故C错误;
,可得n(Cl2)∶n(O2)=2∶3,由电子守恒得化学反应方程式为:8 HClO3=3O2↑+2 Cl2↑+4 HClO4+2H2O,故C错误;
D.若化学计量数a=8,b=3,则化学反应方程式为8HClO3=3O2↑+2 Cl2↑+4 HClO4+2H2O,还原产物只有Cl2,由HClO3→Cl2,Cl元素化合价由+5价降低为0价,故生成2molCl2时转移电子的物质的量为2mol×2×(5-0)=20mol,即该反应中电子转移数目为20e-,故D正确;
故选C。

 名校课堂系列答案
名校课堂系列答案【题目】如图X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味气体放出,符合这一情况的是

a电极 | b电极 | X电极 | 电解质溶液 | |
A | Fe | 石墨 | 正极 | 稀硫酸 |
B | Zn | Cu | 负极 | CuSO4溶液 |
C | 石墨 | Pt | 负极 | AgNO3溶液 |
D | Pt | Cu | 正极 | CuCl2溶液 |
A. A B. B C. C D. D
【题目】常温下.有浓度均为0.1 mol·L-l的下列4种溶液:①NaCN溶液 ②NaOH溶液 ③CH3COONa溶液 ④NaHCO3溶液
HCN | H2CO3 | CH3COOH |
Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)这4种溶液pH由大到小的顺序是____________(填序号)。
(2)④的水解平衡常数Kh= _________。
(3)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③_____ ④(填“>”、“<"、“=”)
(4)向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:______________________。