题目内容
2007年度诺贝尔化学奖,授予致力于研究合成氨与催化剂表面积大小关系的德国科学家格哈德?埃特尔,表彰他在“固体表面化学过程”研究中作出的贡献。下列说法中正确的是
| A.工业生产中,合成氨采用压强越高,温度越低,越有利于提高经济效益。 |
| B.增大催化剂的表面积,能加快合成氨的正反应速率、降低逆反应速率 |
| C.采用催化剂时,反应的活化能降低,使反应易达过渡态,故明显加快 |
| D.增大催化剂的表面积,能增大氨气的产率 |
C
解析试题分析:A、温度太低反应速率太慢,不利于提高经济效益,A不正确;B、催化剂能同等程度改变正逆反应速率,B不正确;C、催化剂能改变活化能,所以采用催化剂时,反应的活化能降低,使反应易达过渡态,故明显加快,C正确;D、催化剂只能改变反应速率,不能改变平衡状态,D不正确,答案选C。
考点:考查催化剂对反应速率和平衡状态的影响

练习册系列答案
 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
下列各组金属与酸的反应,反应刚开始时,放出H2的速率最大的是( )
| | 金属(粉末状)/mol | 酸的浓度及体积 | 反应温度 | ||
| A | Mg | 0.1 | 3mol·L-1盐酸 | 10mL | 25℃ |
| B | Fe | 0.1 | 3mol·L-1盐酸 | 10mL | 25℃ |
| C | Mg | 0.1 | 3mol·L-1硫酸 | 10mL | 25℃ |
| D | Mg | 0.1 | 6mol·L-1硝酸 | 10mL | 60℃ |
可逆反应H2(g)+I2(g)  2HI(g)在密闭容器中反应,达到平衡状态时的标志是( )
2HI(g)在密闭容器中反应,达到平衡状态时的标志是( )
| A.混合气体的密度不再改变 | B.混合气体的颜色不再改变 |
| C.混合气体的压强不再改变 | D.I2、H2在混合气体中的体积分数相等 |
在一定条件下的定容密闭容器中,当物质的下列物理量不再变化时,不能表明反应:A(s)+2B(g) C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
| A.混合气体的压强 | B.混合气体的密度 |
| C.B的物质的量浓度 | D.混合气体的平均相对分子质量 |
下列过程一定不能自发进行的是:
| A.2N2O5(g)=4NO2(g)+O2(g);ΔH>0 |
| B.2CO(g)=2C(s)+O2(g);ΔH>0 |
| C.(NH4)2CO3(s)=NH4HCO3(s)+NH3(g);ΔH>0 |
| D.2H2(g)+O2(g)=2H2O(l);ΔH<0 |
在密闭容器中发生如下反应:mA(g)+nB(g) pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是
| A.平衡向逆反应方向移动 | B.A的转化率降低 |
| C.m+n>p | D.C的体积分数减小 |
COCl2(g) CO(g)+Cl2(g) △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g) △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
| A.①②④ | B.①④⑥ | C.②③⑥ | D.③⑤⑥ |
在一恒容的密闭容器中充入0.1 mol/L CO2、0.1 mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)  2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是
2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是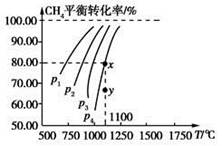
| A.上述反应的ΔH<0 |
| B.压强:p4>p3>p2>p1 |
| C.1100 ℃时该反应平衡常数为1.64 |
| D.压强为p4时,在y点:v正>v逆 |
 xC(g) △H<0,测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是
xC(g) △H<0,测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是