题目内容
下列各组金属与酸的反应,反应刚开始时,放出H2的速率最大的是( )
| | 金属(粉末状)/mol | 酸的浓度及体积 | 反应温度 | ||
| A | Mg | 0.1 | 3mol·L-1盐酸 | 10mL | 25℃ |
| B | Fe | 0.1 | 3mol·L-1盐酸 | 10mL | 25℃ |
| C | Mg | 0.1 | 3mol·L-1硫酸 | 10mL | 25℃ |
| D | Mg | 0.1 | 6mol·L-1硝酸 | 10mL | 60℃ |
C
解析试题分析:由于硝酸有强氧化性,与金属反应一般不产生氢气。排除D选项。对于A、B、二个选项来说,酸的浓度相等,反应的温度相同,则由于金属性Mg>Fe。所以A比B反应速率快。对于A、C来说金属相同,反应温度相同,但是c(H+)C比A大。物质的浓度越大,反应速率就越快。因此反应放出氢气的速率最快的是C。
考点:考查影响化学反应速率的因素的知识。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案下列措施对增大反应速率明显有效地是 ( )
| A.Na与水反应时增大水的用量 |
| B.Fe与稀硫酸反应制取氢气时,改用浓硫酸 |
| C.在K2SO4与BaCl2两溶液反应时,增大压强 |
| D.将铝片改为铝粉,做铝与氧气反应的实验 |
T ℃时,将6 mol CO2和8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)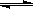 CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是
CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是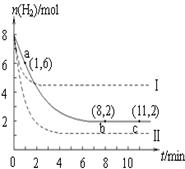
| A.反应开始至a点时v(H2)=1 mol·L-1·min-1 |
| B.若曲线Ⅰ对应的条件改变是升温,则该反应?H>0 |
| C.曲线Ⅱ对应的条件改变是降低压强 |
| D.T ℃时,该反应的化学平衡常数为0.125 |
已知:3CH4(g) + 2N2(g) 3C(s) + 4NH3(g) ΔH>0,在700℃,CH4与N2在不同物质的量
3C(s) + 4NH3(g) ΔH>0,在700℃,CH4与N2在不同物质的量
之比[n(CH4)/n(N2)]时CH4的平衡转化率如下图所示:下列说法正确的是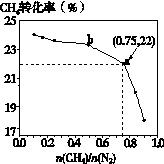
| A.n(CH4)/n(N2)越大,CH4的转化率越高 |
| B.n(CH4)/n(N2)不变时,若升温,NH3的体积分数会增大 |
| C.b点对应的平衡常数比a点的大 |
| D.a点对应的NH3的体积分数约为26% |
一定条件下,尿素[CO(NH2)2]与NO反应生成N2和另 外2种对环境无污染的氧化物。如图是 CO(NH2)2与某种烟气中NO的物质的量之比分别为1:2、2:1、3:1时,NO脱除率随温度(t)变化的图像。下列说法错误的是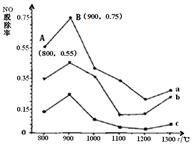
| A.尿素脱除NO的反应为:2CO(NH2)2 + 6NO=2CO2 + 4H2O + 5N2 |
| B.图中a,对应CO(NH2)2与NO的物质的量之比为1:2 |
| C.在900℃左右,NO的脱除率最佳 |
| D.NO的起始浓度为6×10-4 mg / m3,图中a从A点到 B点经过0.8 s,这段时间内NO的脱除平均速率为1.5×10-4 mg / (m3·s) |
决定化学反应速率的主要因素是
| A.参加反应的物质本身的性质 | B.催化剂 |
| C.温度、压强以及反应物的接触面 | D.反应物的浓度 |
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究。已知:CO2(g)+3H2(g) 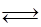 CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。T1℃时,向体积为1L的恒容密闭容器中充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示,且平衡时体系压强为P1。下列叙述中不正确的是
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。T1℃时,向体积为1L的恒容密闭容器中充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示,且平衡时体系压强为P1。下列叙述中不正确的是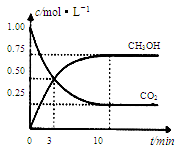
| A.0~3 min内,v(CO2)正 =v (CH3OH)正 |
| B.其他条件不变,若向平衡后的体系中充入1mol氦气,体系压强增大平衡将向正方向移动 |
| C.在T1℃时,若起始时向容器中充入2molCO2和6mol H2 , 测得平衡时容器内压强为P2, 则 P2<2P1 |
| D.T2℃时,上述反应平衡常数为4.2,则T2>T1 |
2007年度诺贝尔化学奖,授予致力于研究合成氨与催化剂表面积大小关系的德国科学家格哈德?埃特尔,表彰他在“固体表面化学过程”研究中作出的贡献。下列说法中正确的是
| A.工业生产中,合成氨采用压强越高,温度越低,越有利于提高经济效益。 |
| B.增大催化剂的表面积,能加快合成氨的正反应速率、降低逆反应速率 |
| C.采用催化剂时,反应的活化能降低,使反应易达过渡态,故明显加快 |
| D.增大催化剂的表面积,能增大氨气的产率 |
对于可逆反应A(g)+2B(g) 2C(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,且使A的浓度增大,应采取的措施是( )
2C(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,且使A的浓度增大,应采取的措施是( )
| A.增大压强 | B.减少B的浓度 | C.减少A的浓度 | D.升高温度 |