题目内容
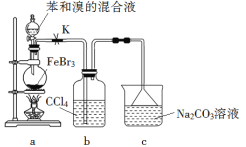
【题目】制备溴苯的实验装置如图所示,请回答下列问题:

(1)该反应装置中仪器A的名称为__________;反应开始前已向仪器A中加入的固体药品是铁粉,而装在左侧分液漏斗中的液体药品是_______。
(2)冷凝管B有上、下两口,冷却水应从_____口进入。
(3)导管口不能插入锥形瓶中的液面之下,其原因是____________。
(4)右侧分液漏斗中的物质在反应_______时加入A中(填写反应前、反应中或者反应后),用离子方程式表达其作用是:_________________。
(5)反应结束向锥形瓶中的液体中加入硝酸酸化的硝酸银溶液,可见到现象是________________。
(6)该反应过程可以如下表述:3Br2+2Fe=2FeBr3;Br2+FeBr3=FeBr4﹣+Br+(不稳定);![]() + Br+ + FeBr4﹣→
+ Br+ + FeBr4﹣→![]() + HBr + FeBr3;由上反应可知:
+ HBr + FeBr3;由上反应可知:![]() +Br2 →
+Br2 → ![]() +HBr中的催化剂为_________。
+HBr中的催化剂为_________。
A、Fe B、FeBr3 C、Br+ D、FeBr4﹣
【答案】三颈烧瓶 苯、液溴 下 防止倒吸 反应后 Br2+2OH﹣=Br﹣+BrO﹣+H2O 浅黄色沉淀 B
【解析】
(1)仪器A为三颈烧瓶,依据实验目的,先加入铁粉,后滴加苯和液溴的混合液体;
(2)冷却水从下方通入。
(3)生成的溴化氢气体极易溶于水;
(4)NaOH溶液的作用是对粗产品进行初步的除杂处理。
(5)采用硝酸酸化的硝酸银溶液,是为了检验溴离子的存在;
(6)催化剂参与了反应的过程,但最终“全身而退”,在后续反应会重新生成。
(1)该反应装置中仪器A是三颈烧瓶,注意不要仅说烧瓶;根据实验目的,三溴化铁是催化剂,苯、液溴是反应物,NaOH溶液是初步除杂试剂;所以装在左侧分液漏斗中的液体药品是苯和液溴(实际是溴和苯形成的溶液);
(2)冷却水应从下口进入,这样才能使整个冷凝管充满水,才具有良好的冷凝效果;
(3)由于生成的HBr气体极易溶解于水,所以导管口不能插入锥形瓶中液面以下,以防止液体倒吸回三颈烧瓶中;
(4)右侧分液漏斗中装的是NaOH溶液,其作用是除去溶解在粗溴苯中的少量液溴,所以应在制取溴苯反应结束后滴加,发生反应的离子方程式为:Br2+2OH﹣=Br﹣+BrO-+H2O;
(5)部分生成的HBr将进入锥形瓶水中形成溶液(当然理论上讲也会有少量溴蒸气进入,所以最好在锥形瓶前加一盛有苯或四氯化碳的洗气瓶),加入硝酸酸化的硝酸银溶液,将产生浅黄色沉淀:Br-+Ag+=AgBr↓,所以此处的实验现象为产生浅黄色沉淀;
(6) 催化剂先是参与了化学反应,后续步骤中又会再次生成。从所给的反应过程中可以看出,铁只参与了反应但最终没有生成,而Br+、FeBr4-只是中间产物(反应中先生成,后消耗),FeBr3在反应中确实是先消耗后生成,符合催化剂的特点,所以答案选择B项。

【题目】某同学在做浓硫酸与铜反应的实验过程中,观察到铜片表面变黑,于是对黑色物质的组成进行实验探究。
(1)用如右图所示装置进行实验1。(加热和夹持仪器已略去)

实验1:铜片与浓硫酸反应
操作 | 现象 |
加热到120℃~250℃ | 铜片表面变黑,有大量气体产生,形成墨绿色浊液 |
继续加热至338℃ | 铜片上黑色消失,瓶中出现“白雾”,溶液略带蓝色,瓶底部有较多灰白色沉淀 |
①装置B的作用是________;装置C中盛放的试剂是_______。
②为证明A装置中灰白色沉淀的主要成分为硫酸铜,实验操作及现象是___________。
(2)探究实验1中120℃~250℃时所得黑色固体的成分。
【提出猜想】黑色固体中可能含有CuO、CuS、Cu2S中的一种或几种。
【查阅资料】
资料1:亚铁氰化钾[K4Fe(CN)6]是Cu2+的灵敏检测剂,向含有Cu2+的溶液中滴加亚铁氰化钾溶液,生成红棕色沉淀。
资料2:
CuS | Cu2S |
黑色结晶或粉末 | 灰黑色结晶或粉末 |
难溶于稀硫酸;可溶于硝酸;微溶于浓氨水或热的浓盐酸 | 难溶于稀硫酸和浓盐酸;可溶于硝酸;微溶于浓氨水 |
【设计并实施实验】
实验2.探究黑色固体中是否含CuO
操作 | 现象 |
i.取表面附着黑色固体的铜片5片,用清水洗干净,放入盛有10mL试剂A的小烧杯中,搅拌 | 黑色表层脱落,露出光亮的铜片 |
ii.取出铜片,待黑色沉淀沉降 | 上层溶液澄清、无色 |
①试剂A是_________。
②甲认为ii中溶液无色有可能是Cu2+浓度太小,于是补充实验确认了溶液中不含Cu2+,补充的实验操作及现象是______。
实验3.探究黑色固体中是否含CuS、Cu2S
操作 | 现象 |
i.取实验2中黑色固体少许,加入适量浓氨水,振荡后静置 | 有固体剩余,固液分界线附近的溶液呈浅蓝色 |
ii.另取实验2中黑色固体少许,加入适量浓盐酸,微热后静置 | 有固体剩余,溶液变成浅绿色 |
【获得结论】由实验2和实验3可得到的结论是:实验1中,120℃~250℃时所得黑色固体中_______。
【实验反思】
分析实验1中338℃时产生现象的原因,同学们认为是较低温度时产生的黑色固体与热的浓硫酸进一步反应造成。已知反应的含硫产物除无水硫酸铜外还有二氧化硫,则黑色固体消失时可能发生的所有反应的化学方程式为_____________。