题目内容
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。回答下列问题:
(1)基态Fe3+的电子排布式为________。
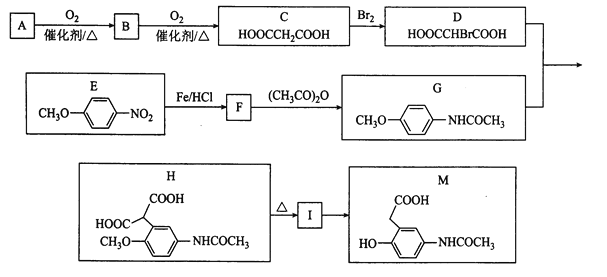
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
(3)FeCl3的熔点为306℃,沸点为315℃ FeCl3的晶体类型是______。FeSO4常作补铁剂,SO42-的立体构型是_______。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等,1 mol Fe(CO)5分子中含σ键数目为_______,与CO互为等电子体的离子是__________(填化学式,写一种)
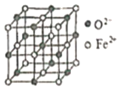
(5)氮化铁晶体的晶体结构示意图如图所示。该晶体中铁、氮的微粒个数之比为______。
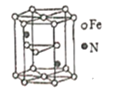
(6)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-1,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短间距为_______ pm。
【答案】1s22s22p63s23p63d5或[Ar] 3d5 N>O>S sp2 分子晶体 正四面体形 10NA CN- 或C22- 3∶1 12 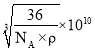
【解析】
根据原子或离子的核外电子排布规律分析解答;根据等电子体的概念分析解答;用“均摊法”确定晶胞中所含微粒的个数。
(1) Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子和3d能级1个电子形成Fe3+,Fe3+电子排布式为1s22s22p63s23p63d5或[Ar] 3d5;
故答案为1s22s22p63s23p63d5或[Ar] 3d5;
(2) 根据同周期同主族元素性质递变规律判断,由于同一周期由左向右元素原子的第一电离能呈递增趋势,但氮原子2p轨道为半充满状态,第一电离能比相邻的元素都大,得N>O;又由于同主族由上到下元素原子的第一电离能逐渐减小,得O>S ,所以N、O、S三种元素的第一电离能从大到小的顺序为N>O>S;苯环中的C形成3个σ键,无孤电子对,所以苯酚中碳原子的杂化轨道类型为sp2杂化;
故答案为:N>O>S,sp2杂化;
(3) FeCl3的熔点为306℃,沸点为315℃,熔沸点较低,所以 FeCl3的晶体类型是分子晶体; SO42-中S原子价层电子对=4+![]() (6+2-4×2)=4,且不含孤电子对,所以其立体构型是正四面体,硫原子采取sp3杂化;
(6+2-4×2)=4,且不含孤电子对,所以其立体构型是正四面体,硫原子采取sp3杂化;
故答案为分子晶体,正四面体;
(4) 一个CO分子中含有一个σ键,Fe和CO形成配位键,配位键也是σ键,因此1molFe(CO)5分子中含有10molσ键;等电子体是指价电子数和原子数相同的分子、离子或原子团。与CO互为等电子体的离子可能是CN-或C22-;
故答案为10 ,CN-或C22-;
(5) 氮化铁晶胞为六棱柱,顶点贡献率为![]() ,棱点贡献率为
,棱点贡献率为![]() ,面点贡献率为
,面点贡献率为![]() ,观察晶胞知,12个铁位于顶点,2个铁位于面心,3个铁位于体内,两个氮原子位于体内,所以该晶胞中Fe原子个数为:12×
,观察晶胞知,12个铁位于顶点,2个铁位于面心,3个铁位于体内,两个氮原子位于体内,所以该晶胞中Fe原子个数为:12×![]() +2×
+2×![]() +3=6,N原子数为2,故该晶体中铁、氮的微粒个数之比为6∶2=3∶1;
+3=6,N原子数为2,故该晶体中铁、氮的微粒个数之比为6∶2=3∶1;
故答案为3∶1;
(6)根据晶胞图可知,氧化亚铁晶胞类似氯化钠晶胞,棱上3个离子相切,晶胞参数等于相邻两个离子核间距的2倍;上、中、下三层各4个氧离子(共12个氧离子)与中心的氧离子紧邻且等距离,所以,有12个Fe2+与Fe2+紧邻且等距离;用“均摊法”,1个晶胞中含有Fe2+个数为:6×![]() +8×
+8×![]() =4,含有O2-个数为:12×
=4,含有O2-个数为:12×![]() +1=4,所以1个氧化亚铁晶胞中含4个FeO,设Fe2+与O2-的最短间距为apm,根据密度关系:
+1=4,所以1个氧化亚铁晶胞中含4个FeO,设Fe2+与O2-的最短间距为apm,根据密度关系: 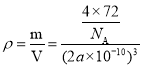 ,可得到
,可得到 。
。
故答案为12 ,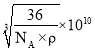 。
。

【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀 |
B | CO2通入BaCl2溶液中 | 有白色沉淀出现 | 生成了BaCO3沉淀 |
C | Al箔插入稀 | 无现象 | Al箔表面被 |
D | 用玻璃棒蘸取浓硝酸点到蓝色石蕊试纸上 | 试纸先变红色后褪色 | 浓硝酸有酸性和氧化性 |
A.AB.BC.CD.D