题目内容
有关元素A、B、C、D、E、F的信息如下:| 元 素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | M层上有3个电子 |
| D | 短周期原子半径最大的主族元素 |
| E | 最高正价与最低负价代数和为6 |
(1)写出物质甲与乙反应的离子方程式______
(2)下列说法不正确的是______(填序号).
①实验室可用右图所示装置制取B的最高价氧化物
②用C单质做成的槽车,可用来运输甲的浓溶液
③C和铜与稀硫酸组成的原电池,C电极被还原
(3)若用石墨做电极电解元素D、E组成的化合物饱和水溶液,写出电解反应的离子方程式为:______
(4)已知:2AO2(g)
 A2O4(g);△H<0.在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示.
A2O4(g);△H<0.在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示.①该反应是由______开始反应的.(填“正反应”、“逆反应”、或“正逆反应同时”.)
②a、b两个点中,表示化学反应处于平衡状态的点是______.
③前10min内用AO2表示的化学反应速率v(AO2)=______mol?L-1?min-1.

B最外层电子数是次外层电子数的2倍,应为C元素;
CM层上有3个电子,应为Al元素;
D短周期原子半径最大的主族元素,应为Na元素;
E最高正价与最低负价代数和为6,则最高正价为+7,应为Cl元素.
(1)根据A最高价氧化物对应的水化物(甲)为HNO3,气态氢化物(乙)为NH3,书写反应的离子方程式;
(2)①B为C元素,对应的最高价氧化物为CO2,可用CaCO3和盐酸反应制备;
②Al与冷的浓硝酸发生钝化反应,在表面生成一层致密的氧化物膜,阻碍反应的继续进行;
③Al和铜与稀硫酸组成的原电池中,Al较活泼,应作原电池的负极;
(3)电解饱和NaCl溶液,生成NaOH、H2、Cl2,反应的离子方程式为2Cl-+2H2O=2OH-+H2↑+Cl2↑;
(4)①反应为可逆反应,所加入的物质既有反应物,也有生成物,则正逆反应同时;
②a、b两个点中,b点物质的浓度不再发生变化,应达到平衡状态b;
③化学反应中,物质的量浓度变化之比等于化学计量数之比,则X为NO2的变化曲线,Y为 N2O4的变化曲线.
解答:解:A最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐,说明生成的盐含有的元素全部为非金属元素,则应为N;
B最外层电子数是次外层电子数的2倍,应为C元素;
CM层上有3个电子,应为Al元素;
D短周期原子半径最大的主族元素,应为Na元素;
E最高正价与最低负价代数和为6,则最高正价为+7,应为Cl元素.
(1)A最高价氧化物对应的水化物(甲)为HNO3,气态氢化物(乙)为NH3,二者反应的离子方程式为H++NH3=NH4+,故答案为:H++NH3=NH4+;
(2)①B为C元素,对应的最高价氧化物为CO2,可用CaCO3和盐酸反应制备,反应不用加热,可用①图装置制备,故①正确;
②Al与冷的浓硝酸发生钝化反应,在表面生成一层致密的氧化物膜,阻碍反应的继续进行,所以可用Al制备的槽车运输浓硝酸,故②正确;
③Al和铜与稀硫酸组成的原电池中,Al较活泼,应作原电池的负极,被氧化,故③错误,
故答案为:③;
(3)电解饱和NaCl溶液,生成NaOH、H2、Cl2,反应的离子方程式为2Cl-+2H2O=2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O=2OH-+H2↑+Cl2↑;
(4)已知:2NO2(g)
 N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,
N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,①反应为可逆反应,所加入的物质既有反应物,也有生成物,则正逆反应同时,故答案为:正逆反应同时;
②a、b两个点中,b点物质的浓度不再发生变化,应达到平衡状态,故答案为:b;
③化学反应中,物质的量浓度变化之比等于化学计量数之比,则X为NO2的变化曲线,Y为 N2O4的变化曲线,
v(NO2)=
 =0.04mol?L-1?min-1,故答案为:0.04.
=0.04mol?L-1?min-1,故答案为:0.04.点评:本题考查较为综合,涉及元素的推断,电化学以及化学平衡等问题,题目难度综合度较高,难度较大,本题易错点为(4),注意化学平衡图象的分析.

有关元素A、B、C、D、E的信息如下:
| 元素 | 有关信息 |
| A | 元素主要化合价为-2,A的一种氢化物可用于实验室制取A的单质 |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子中含10个P电子 |
| D | 最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 |
| E | 生活中常见金属,它有两种氯化物,相对原子质量相差35.5 |
请回答下列问题:
 (1)元素A~E中两种元素组成的化合物使品红溶液褪色的物质的化学式为______。
(1)元素A~E中两种元素组成的化合物使品红溶液褪色的物质的化学式为______。
(2)E元素与B元素可形成EB2和EB3两种化合物,下列说法正确的是(填序号)________。
①保存EB2溶液时,需向溶液中加入少量E单质
②EB2只能通过置换反应生成,EB3只能通过化合反应生成
③铜片、碳棒和EB3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴EY3的浓溶液,原无色溶液都变为紫色
(3)用化学符号表示D2C的水溶液中各粒子的浓度关系,如c(C2-)=______________。
(4)将一定量的B单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中含有三种含B元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如下图所示。该苛性钾溶液中KOH的质量是___________,该反应中转移电子的物质的量是_________。
(5)工业上冶炼E单质的化学方程式为__________________________________。
(15分)有关元素A.B.C.D的信息如下:
| 元 素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 地壳中含量最高的元素,A与B可形成一种质量比为 7︰12的化合物(丙) |
| C | 单质曾用于焊接钢轨 |
| D | 单质是生活中常见金属,其制品在自然环境中被腐蚀呈现红棕色 |
请回答下列问题:
(1)乙分子的空间构型________,用电子式表示乙的形成过程____________________。
(2)有关C与D元素,下列说法正确的是____________________ (填序号)。
①C或D的高价盐均可用做净水剂
②用C或D单质做成的槽车,都可用来运输甲的稀溶液
③C、D的单质与稀硫酸组成的原电池,C电极发生氧化反应
④C的合金可用来做车船材料和门窗等
(3)B的一种氢化物在碱性溶液中可与丙反应,生成物中A元素只显其最高价态,该反应的离子方程式是________________________________________。
(4)现取1 mol/L 100 mL的C的氯化物溶液,向其中加入1 mol/L氢氧化钠溶液产生了3.9 g的沉淀,则加入的氢氧化钠溶液体积可能是____________________mL。
(5)已知:2AB2(g) A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。

① a、b、c、d四个点中,化学反应处于平衡状态的是_______点。
② 25 min时,增加了_______(填物质的化学式)________mol。
③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是_______(填字母)。
(15分)有关元素A.B.C.D的信息如下:
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 地壳中含量最高的元素,A与B可形成一种质量比为 7︰12的化合物(丙) |
| C | 单质曾用于焊接钢轨 |
| D | 单质是生活中常见金属,其制品在自然环境中被腐蚀呈现红棕色 |
(1)乙分子的空间构型________,用电子式表示乙的形成过程____________________。
(2)有关C与D元素,下列说法正确的是____________________ (填序号)。
① C或D的高价盐均可用做净水剂
②用C或D单质做成的槽车,都可用来运输甲的稀溶液
③ C、D的单质与稀硫酸组成的原电池,C电极发生氧化反应
④ C的合金可用来做车船材料和门窗等
(3)B的一种氢化物在碱性溶液中可与丙反应,生成物中A元素只显其最高价态,该反应的离子方程式是________________________________________。
(4)现取1 mol/L 100 mL的C的氯化物溶液,向其中加入1 mol/L氢氧化钠溶液产生了3.9 g的沉淀,则加入的氢氧化钠溶液体积
 可能是____________________mL。
可能是____________________mL。(5)已知:2AB2(g)
 A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
[来源:学。科。网Z。X。X。K]
 ① a、b、c、d四个点中,化学反应处于平衡状态的是_______点。
① a、b、c、d四个点中,化学反应处于平衡状态的是_______点。② 25 min时,增加了_______(填物质的化学式)________mol。
③ a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是_______(填字母)。
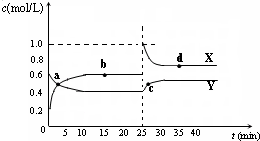 容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
 A2O4(g);△H<0.在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示.
A2O4(g);△H<0.在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示.