题目内容
5.1个H2含2个H,1mol H2含2mol H、1.204×1024个H.分析 1个H2分子含有2个H原子,氢原子物质的量为氢气分子的2倍,根据N=nNA计算H原子数目.
解答 解:1个H2分子含有2个H原子,1mol H2含H原子物质的量为1mol×2=2mol,含有H原子数目为2mol×6.02×1023mol-1=1.204×1024,
故答案为:2;2;1.204×1024.
点评 本题考查物质的量有关计算,比较基础,注意对化学式意义的理解掌握.

练习册系列答案
相关题目
15.判断含氧酸强弱的一条经验规律:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强.几种实例如下表所示.
(1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)的分子式相似,但它们的酸性差别很大.亚磷酸是中强酸,亚砷酸既有弱酸性又有弱碱性,由此可推出它们的结构式分别为:亚磷酸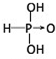 ,亚砷酸
,亚砷酸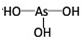 .
.
(2)分别写出亚磷酸和亚砷酸与过量的NaOH溶液反应的化学方程式.亚磷酸:H3PO3+2NaOH=Na2HPO3+2H2O,亚砷酸:H3AsO3+3NaOH=Na3AsO3+3H2O.
(3)比较H3AsO4、H2CrO4、HMnO4的酸性强弱,酸性由弱到强的顺序H3AsO4、H2CrO4、HMnO4.
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | 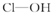 | 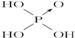 | 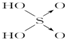 | 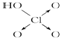 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 ,亚砷酸
,亚砷酸 .
.(2)分别写出亚磷酸和亚砷酸与过量的NaOH溶液反应的化学方程式.亚磷酸:H3PO3+2NaOH=Na2HPO3+2H2O,亚砷酸:H3AsO3+3NaOH=Na3AsO3+3H2O.
(3)比较H3AsO4、H2CrO4、HMnO4的酸性强弱,酸性由弱到强的顺序H3AsO4、H2CrO4、HMnO4.
16.类推法在化学学习中经常采用,下列类推的结论正确的是( )
| A. | 由Cl2+2KBr═2KCl+Br2所以F2也能与KBr溶液反应置换出Br2 | |
| B. | 常温下,由Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,所以Fe也能与浓硝酸反应产生NO2 | |
| C. | 由Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2 所以Cu+I2$\frac{\underline{\;\;△\;\;}}{\;}$CuI2 | |
| D. | 由钠保存在煤油中,所以钾也可以保存在煤油中 |
13.下列推断正确的是( )
| A. | 1mol Na2O2与水反应,转移电子1mol | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应的产物也相同 | |
| C. | 钠能与氧气和水反应,钠暴露在空气中最终的产物是NaOH | |
| D. | 将0.01mol的Na2O和Na2O2分别投入同质量的水中,所得到的溶质质量分数不同 |
20.下列是元素A的两种同位素的资料
元素A的近似相对原子质量为104.6(列出计算式)
| 同位素 | 同位素的质量分数 | 原子百分比 |
| 103A | 103 | 20% |
| 105A | 105 | 80% |
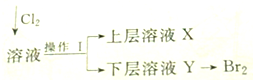 实验室用含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的溶液进行有关实验.已知:Cl2+2Br-=Br2+2Cl-.
实验室用含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的溶液进行有关实验.已知:Cl2+2Br-=Br2+2Cl-.