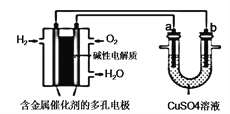
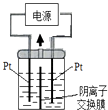
题目内容
【题目】下列每组物质发生状态变化所克服的粒子间的相互作用属于同种类型的是
A. 食盐和蔗糖熔化 B. 钠和硫熔化
C. 碘和干冰升华 D. 二氧化硅和氧化钠熔化
【答案】C
【解析】试题分析:A中前者克服的是离子键,后者是分子间作用力;B中前者是金属键,后者是分子间作用力;C中都分子间作用力;D中前者是共价键,后者是离子键,答案选C。

 探究与巩固河南科学技术出版社系列答案
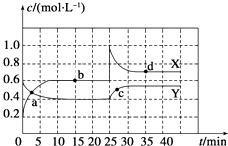
探究与巩固河南科学技术出版社系列答案【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g) +Y(g)![]() 2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法不正确的是
A. 反应前2min的平均速率v(Z)=4.0×10-3mol/(L·min)
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)<v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5 , 反应PCl5(g)═PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50 s的平均速率v(PCl3)=0.0032molL﹣1s﹣1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11molL﹣1 , 则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20mol Cl2 , 反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0mol Cl2 , 达到平衡时,PCl3的转化率小于80%