题目内容
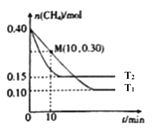
【题目】已知NO2和N2O4可以相互转化:2NO2(g)N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图所示.下列说法正确的是( ) 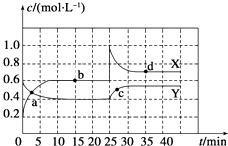
A.图中的两条曲线,Y是表示NO2浓度随时间的变化曲线
B.前10 min内用v(NO2)表示的化学反应速率为0.06 molL﹣1min﹣1
C.25 min时,导致平衡移动的原因是将密闭容器的体积缩小为1 L
D.a、b、c、d四个点中,只有b、d点的化学反应处于平衡状态
【答案】D
【解析】解:由图可知0﹣10minmin平衡状态时,X表示的生成物的浓度变化量为(0.6﹣0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6﹣0.4)mol/L=0.2mol/L,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线. A、由上述分析可知,X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线,故A错误;
B、由图象可知,10 min内用NO2的浓度变化量为(0.6﹣0.4)mol/L=0.2mol/L,故v(NO2)= ![]() =0.04mol/(Lmin),故B错误;
=0.04mol/(Lmin),故B错误;
C、25min时,X的浓度增大,Y的浓度不变,只能是增大X的浓度,所以曲线发生变化的原因是增加NO2浓度,故C错误;
D、由图可知,10﹣25min及30min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,即b、d处于化学平衡状态,故D正确;
故选D.

【题目】已知某一种燃料含碳、氢和氧三种元素,为测定该燃料的组成:将该燃料放入到足量氧气中燃烧,并使产生的CO2与H2O蒸气以及剩余的O2全部通过如下图所示的装置,得到如下表所列出的实验数据(假设生成的气体是全部被吸收)。
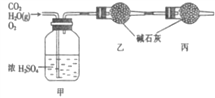
实验前 | 实验后 | |
甲的质量 / g | 101.1 | 103.8 |
乙的质量 / g | 82.0 | 86.4 |
根据实验数据填空:
(1)该燃料分子中碳、氢原子的数目比为_______。
(2)已知该燃料分子的式量为46,且每个分子中含有1个氧原子,则其分子式为________________。