题目内容
海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
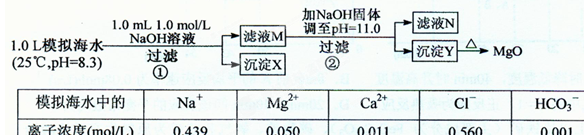
注:溶液中某种离子的浓度小于1.0×10-5mo1/L,可认为该离子不存在;已知:Ksp(CaCO3)= 4.96×10-9; Ksp(MgCO3)= 6.82× 10-6; Ksp[Ca(OH)2]=4.68×l0-6; Ksp[Mg(OH)2]=5.61×l0-12。
下列说法正确的是(假设实验过程中溶液体积不变)( )

注:溶液中某种离子的浓度小于1.0×10-5mo1/L,可认为该离子不存在;已知:Ksp(CaCO3)= 4.96×10-9; Ksp(MgCO3)= 6.82× 10-6; Ksp[Ca(OH)2]=4.68×l0-6; Ksp[Mg(OH)2]=5.61×l0-12。
下列说法正确的是(假设实验过程中溶液体积不变)( )
| A.沉淀物X为CaCO3 |
| B.滤液M中存在Mg2+,不存在Ca2+ |
| C.滤液N中存在Mg2+、Ca2+ |
| D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物 |
A
步骤①发生Ca2++OH-+ HCO3-="==" CaCO3↓+H2O;步骤②:Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6。Q[Ca(OH)2]=c(Ca2+)×(10-3)2=10-8<Ksp,无Ca(OH)2析出。A选项正确,生成0001 mol CaCO3。B选项错误,剩余c(Ca2+)=0.001 mol/L。C选项错误,c(Mg2+)=5.6×10-6<10-5,无剩余,D选项错误,生成0.05 mol Mg(OH)2,余0.005 mol OH-,Q[Ca(OH)2]=0.01×0.0052=2.5×10-7<Ksp,无Ca(OH)2析出。

练习册系列答案
相关题目
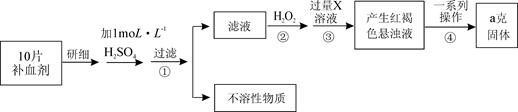
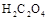 )分解的化学方程式为:
)分解的化学方程式为: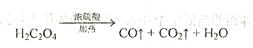
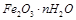 和
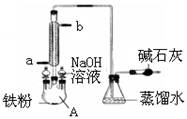
和 两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。
两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。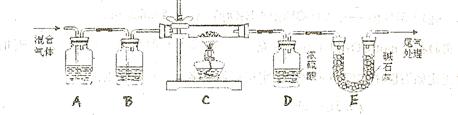
 体积
体积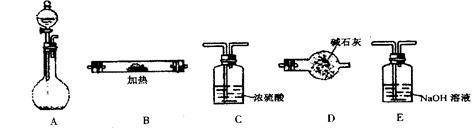
 操作是 。
操作是 。 连接顺序是(填字母)( )→(
连接顺序是(填字母)( )→(  )→( )→E
)→( )→E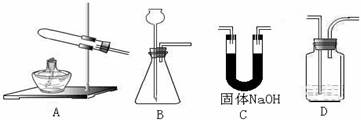
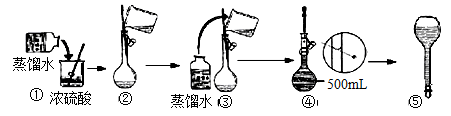
 LH2SO4,加入400mL水
LH2SO4,加入400mL水 5mol/LH2SO4,加500mL水稀释
5mol/LH2SO4,加500mL水稀释