题目内容
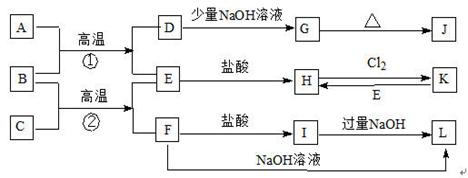
(11分)过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气, 因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铝)等为原料制取过氧化钙(CaO2)的流程。

请回答下列问题:
(1)①中实验操作顺序为 (填序号)。
a.过滤 b.蒸馏 C.分液 d.蒸发结晶
(2)用氨水调节pH至7~8的目的是 。
(3)写出生成滤渣B的离子方程式 。
(4)若在滤液C中,加入HNO3,使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,
c(NH4+) c(N03-)(填“≥”、“≤”、“<”、“>”或“=”)
(5)操作②是在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式 。一段时间后,再加入氢氧化钠溶液,调节溶液的pH至9~11, 出现大量沉淀。用简要的文字解释需用氢氧化钠调节pH至9~ll的原因 。

请回答下列问题:
(1)①中实验操作顺序为 (填序号)。
a.过滤 b.蒸馏 C.分液 d.蒸发结晶
(2)用氨水调节pH至7~8的目的是 。
(3)写出生成滤渣B的离子方程式 。
(4)若在滤液C中,加入HNO3,使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,
c(NH4+) c(N03-)(填“≥”、“≤”、“<”、“>”或“=”)
(5)操作②是在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式 。一段时间后,再加入氢氧化钠溶液,调节溶液的pH至9~11, 出现大量沉淀。用简要的文字解释需用氢氧化钠调节pH至9~ll的原因 。
(1)da(2分)(2)除去Al3+(1分)(3)Al3++3NH3?H2O= Al(OH)3↓+3NH4+,(2分)
(4)<(2分)(5)CaCl2+H2O2CaCl2+H2O2=CaO2+2HCl(或CaCl2+H2O2+2NaOH=2NaCl+2H2O+CaO2↓)(2分),加人氢氧化钠使上述平衡向右移动,有利于CaO2沉淀的生成。(2分)
(4)<(2分)(5)CaCl2+H2O2CaCl2+H2O2=CaO2+2HCl(或CaCl2+H2O2+2NaOH=2NaCl+2H2O+CaO2↓)(2分),加人氢氧化钠使上述平衡向右移动,有利于CaO2沉淀的生成。(2分)
本题属于工业流程题,解题时要弄清楚每步操作的目的,从而理清思路:发生的反应有哪些(反应物、生成物是什么)、物质如何分离、提纯、制备、为什么要这样处理等。操作①加盐酸将碳酸钙溶解,然后蒸发析出晶体再过滤得CaCl2? H2O,用氨水pH至7~8的目的是将Al3+沉淀而分离出去,滤渣B为Al(OH)3,滤液C含NH4NO3、(NH4)2CO3,加入HNO3后得NH4NO3,由题意知c(NH4+)<c(N03-),(5)根据流程及质量守恒定律知反应为:CaCl2+H2O2CaCl2+H2O2=CaO2↓+2HCl,因此加氢氧化钠的目的是中和盐酸使上述平衡向右移动,有利于CaO2沉淀的生成。(考查学生思考加氢氧化钠与反应混合物有无作用,出现大量沉淀说明了什么等思维能力)。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目