题目内容
【题目】现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱,部分工艺流程如下:
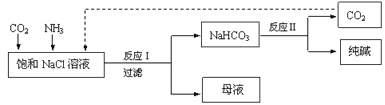
有关说法错误的是
A.反应Ⅰ原理为CO2 + NH3+ NaCl + H2O → NaHCO3↓ + NH4Cl
B.向饱和NaCl溶液中先通入足量的CO2,再通入足量的NH3
C.反应Ⅰ生成的沉淀,经过过滤、洗涤、煅烧可得到纯碱
D.往母液中通入氨气,加入细小的食盐颗粒并降温,可使氯化铵析出
【答案】B
【解析】
A、在氨气饱和的氯化钠溶液中通入CO2气体生成碳酸氢钠晶体和氯化铵,即CO2 + NH3+ NaCl + H2O = NaHCO3↓ + NH4Cl,A正确;
B、CO2在水中的溶解度小,所以要先通入氨气,后通入CO2,B错误;
C、碳酸氢钠受热分解生成碳酸钠、水和CO2,C正确;
D、根据NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓及流程图知,母液中溶质为氯化铵,向母液中通氨气加入细小食盐颗粒,冷却析出副产品,通入的氨气和水反应生成一水合氨,一水合氨电离出铵根离子,铵根离子浓度增大有利于析出氯化铵,D正确。
答案选B。

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目








