题目内容
2.下列各操作中,适宜用来制备氢氧化铝的是( )| A. | 将氧化铝放入水中共热 | |
| B. | 将金属钠投入氯化铝溶液中 | |
| C. | 将足量氨水滴入氯化铝溶液中 | |
| D. | 将足量氢氧化钠溶液滴入氯化铝溶液中 |
分析 A、氧化铝不溶于水,不与水反应;
B、钠和水反应生成氢氧化钠溶液,氢氧化钠溶液和氯化铝溶液反应可能生成氢氧化铝沉淀,但也可能生成偏铝酸钠;
C、氢氧化铝不溶于氨水;
D、足量氢氧化钠溶液和氯化铝溶液反应生成偏铝酸钠.
解答 解:A、氧化铝不溶于水,不与水反应,不能生成氢氧化铝,故A错误;
B、钠和水反应生成氢氧化钠溶液,氢氧化钠溶液和氯化铝溶液反应,和氢氧化钠的量有关,可能生成氢氧化铝沉淀,但也可能生成偏铝酸钠,不适宜制备氢氧化铝,故B错误;
C、氢氧化铝不溶于氨水,将足量氨水滴入氯化铝溶液中反应生成氢氧化铝和氯化铵,适宜制备氢氧化铝,故C正确;
D、氢氧化铝是两性氢氧化物,溶于过量的氢氧化钠溶液,足量氢氧化钠溶液和氯化铝溶液反应生成偏铝酸钠,不能得到氢氧化铝,故D错误;
故选C.
点评 本题考查了铝及其化合物性质的分析判断,主要是氢氧化铝性质的理解应用,掌握氢氧化铝的两性性质是解题关键,题目较简单.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案
相关题目
12.图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述正确的是( )
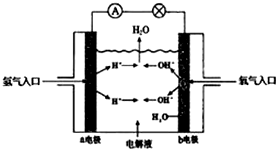

| A. | a电极是正极 | |
| B. | b电极的电极反应为:4OH--4e-=2H2O+O2 | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 氢氧燃料电池是一种具有应用前景的绿色电源 |
13.下列六个图中,横坐标为某溶液中加入某物质的物质的量,纵坐标为生成沉淀的物质的量,请把表中各反应的相应图象的序号填入表中.


| 溶液 | 加入的物质 | 答案序号 |
| 饱和石灰水 | 通过量CO2 | |
| AlCl3溶液 | 通过量NH3 | |
| MgCl2、AlCl3混合溶液 | 逐滴加NaOH溶液至过量 | |
| AlCl3溶液 | 逐滴加NaOH溶液至过量 | |
| 含少量HCl的AlCl3溶液 | 逐滴加NaOH溶液至过量 | |
| FeCl3溶液 | 逐滴加NaOH溶液至过量 |
10.${\;}_1^1H、$${\;}_1^2H、$${\;}_1^3H、$H+、H2,下列说法正确的是( )
| A. | 具有相同的质子数 | B. | 具有不同的电子数 | ||
| C. | 这些微粒互称同位素 | D. | 它们是氢元素不同的五种微粒 |
17.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | 镁离子的电子式Mg2+ | B. | Cl的结构示意图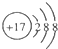 | ||
| C. | 氯离子的电子式Cl- | D. | 质量数为37的氯原子 ${\;}_{37}^{17}$Cl |
9.下列说法正确的是( )
| A. | 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物 | |
| B. | 可逆反应达到平衡后,正、逆反应速率均为0 | |
| C. | 2 mol SO2 与1 mol O2混合一定能生成2 mol SO3 | |
| D. | 使用催化剂不一定能加大反应速率 |
