��Ŀ����
����Ŀ���������һ��ǿ���������ڲ�ͬ������KClO3��KI����ΪI2��KIO3��ijʵ��С����ʵ�����ж�KClO3��KI�ķ�Ӧ������̽�����ش��������⣺
ʵ��һ����ȡ�����
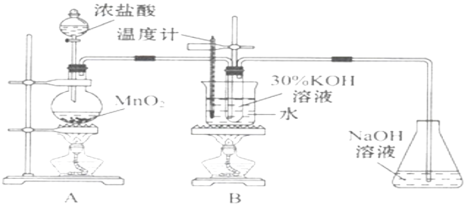
��1��A�з�Ӧ�Ļ�ѧ����ʽΪ_______��ʵ�鿪ʼʱ�����Ƚ��е�ʵ�鲽����________��
��2��A��Bװ��֮��ȱ�ٳ�ȥ�������Ȼ����װ�ã��Ƿ���ʵ������������Ӱ�죬��������__����ǡ�����ѡ���ǡ���˵�����ɣ���ѡ������˵�����ɣ�
ʵ������������⻯�ط�Ӧ���о�
��3����С���о������Է�Ӧ�����Ӱ�죬ϵ��aʵ��ļ�¼�����£�ʵ���������½��У���
�Թܱ�� | 1 | 2 | 3 | 4 |
0.20molL��1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3��s��/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL��1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
����ˮ/mL | 9.0 | 6.0 | 3.0 | 0 |
ʵ������ |
��ϵ��aʵ���ʵ��Ŀ����__�������1���Թ�ʵ���������__��
����2���Թ�ʵ����������Һ��Ϊ��ɫ��ȡ��������Һ���������Һ����ɫ��������������Ψһ����ԭ����ΪKCl����˷�Ӧ�����ӷ���ʽΪ______ ��
���𰸡�MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O ���װ�������� ��,�����л�����Ȼ������KOH��Ӧ����������صIJ��� �о���Ӧ��ϵ������Ũ�ȶԷ�Ӧ�����Ӱ�� ����Ũ��Ϊ0�Ķ���ʵ�� ClO3-+6I-+6H+= Cl-+3I2+3H2O
MnCl2+Cl2��+2H2O ���װ�������� ��,�����л�����Ȼ������KOH��Ӧ����������صIJ��� �о���Ӧ��ϵ������Ũ�ȶԷ�Ӧ�����Ӱ�� ����Ũ��Ϊ0�Ķ���ʵ�� ClO3-+6I-+6H+= Cl-+3I2+3H2O
��������
ʵ��һ��Ŀ������ȡKClO3������ʵ��װ��ͼ����A��MnO2��ŨHCl������Cl2����Ӧ�Ļ�ѧ����ʽΪMnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O����B��Cl2��30%KOH��Һ������KClO3����Ӧ�Ļ�ѧ����ʽΪ3Cl2+6KOH
MnCl2+Cl2��+2H2O����B��Cl2��30%KOH��Һ������KClO3����Ӧ�Ļ�ѧ����ʽΪ3Cl2+6KOH![]() 5KCl+KClO3+3H2O������������лӷ��ԣ�A���Ƶõ�Cl2�л���HCl��g����HCl������KOHʹKClO3���ʽ�����Cl2��ͨ��Bװ��ǰҪ��ȥ���е�HCl��g����C��NaOH��Һ���ն���Cl2����ֹ��Ⱦ������
5KCl+KClO3+3H2O������������лӷ��ԣ�A���Ƶõ�Cl2�л���HCl��g����HCl������KOHʹKClO3���ʽ�����Cl2��ͨ��Bװ��ǰҪ��ȥ���е�HCl��g����C��NaOH��Һ���ն���Cl2����ֹ��Ⱦ������
ʵ������о�KClO3��KI�ķ�Ӧ�����ݱ������ݷ���������ʵ����ʹ���˵�Ũ�ȡ��������KI�͵�������KClO3��H2SO4��Ũ�Ȳ�ͬ��ʵ���Ŀ����̽����Ӧ��ϵ������Ũ�ȶԷ�Ӧ�����Ӱ����1���Թ�û�м����ᣬ1���Թ�Ϊ����ʵ����2���Թ�ʵ����������Һ��Ϊ��ɫ��ȡ��������Һ���������Һ����ɫ��˵��I-��������I2��KClO3�Ļ�ԭ����ΪKCl������������ԭ��Ӧ�е�ʧ�����غ�͵���غ㡢ԭ���غ���д���ӷ���ʽ��
�����������ش�
��1��A��MnO2��ŨHCl�����Ʊ�Cl2��A�з�Ӧ�Ļ�ѧ����ʽΪMnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O��ʵ�鿪ʼʱ�����Ƚ��е�ʵ�鲽���ǣ����װ�õ������ԡ�
MnCl2+Cl2��+2H2O��ʵ�鿪ʼʱ�����Ƚ��е�ʵ�鲽���ǣ����װ�õ������ԡ�
��2������������лӷ��ԣ�A���Ƶõ�Cl2�л���HCl��g����A��Bװ��֮��ȱ�ٳ�ȥCl2��HCl��g����װ�ã���ʵ�������������Ӱ�죬�����ǣ������л�����Ȼ������KOH��Ӧ����������صIJ�����
��3�������ݱ������ݷ���������ʵ����ʹ���˵�Ũ�ȡ��������KI�͵�������KClO3��H2SO4��Ũ�Ȳ�ͬ��ϵ��aʵ���ʵ��Ŀ���ǣ��о���Ӧ��ϵ������Ũ�ȶԷ�Ӧ�����Ӱ����
��1���Թ�û�м����ᣬ���1���Թ�ʵ��������ǣ�����Ũ��Ϊ0�Ķ���ʵ����
��2���Թ�ʵ����������Һ��Ϊ��ɫ��ȡ��������Һ���������Һ����ɫ��˵��I-��������I2��KClO3�Ļ�ԭ����ΪKCl����Ӧ��д��ClO3-+I-+H+��Cl-+I2+H2O��1molClO3-�õ�6mol������1molI-ʧȥ1mol���ӣ����ݵ�ʧ�����غ���ƽΪClO3-+6I-+H+��Cl-+3I2+H2O�����ԭ���غ㡢����غ㣬��Ӧ�����ӷ���ʽΪClO3-+6I-+6H+=Cl-+3I2+3H2O��