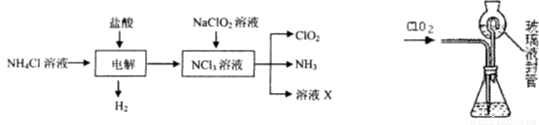
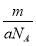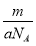题目内容
将0.1 mol的镁和铝的混合物溶于50 mL 4 mol·L-1 H2SO4溶液中,然后再滴加2 mol·L-1的NaOH溶液。请回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V的变化如图所示。当V1=80 mL时,计算金属粉末中镁的物质的量及V2的体积。
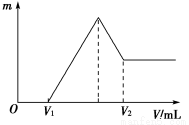
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,计算滴入NaOH溶液的体积。
(1) n(Mg)=0.06mol (2分); V2=220mL(2分)
(2)V(NaOH)=200mL(2分)
【解析】
试题分析:(1)由图像可知:V1 mL的NaOH溶液是与过量H2SO4反应的,则与Mg、Al反应的为H2SO4:
0.2mol-0.16mol× =0.12mol。假设n(Mg)=x mol,n(Al)=y mol,根据反应关系式 ,解得:x=0.06 mol,y=0.04 mol。当加入V2 mL NaOH溶液时,得到Mg(OH)2↓和NaAlO2,关系式为:
Mg2+~2OH-,Al3+~4OH-,∴V2=80+140 =220 mL。(2)当Mg2+、Al3+刚好沉淀完全时,溶液中只有Na2SO4,关系式为2NaOH~H2SO4,∴V(NaOH)= =200 mL。
考点:考查镁和铝与酸反应的计算、化学图像的相关计算。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目