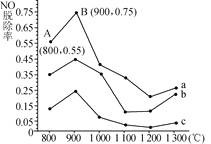
��Ŀ����
����Ŀ��I�����������������ν��з��룿�뽫����ķ������ں����ϡ�
��1��ˮ�;ƾ���_____
��2��������Ȼ�̼��_____
��3��ˮ�����Ȼ�̼��_____
��4����������Һ�е��Ȼ�����_____
II����ͼ��ijѧУʵ���Ҵӻ�ѧ�Լ��̵���ص�Ũ�����Լ���ǩ�ϵIJ������ݡ�

�����ø�Ũ�������Ƴ�1mol/L��ϡ���ᣬ��ʵ���ҽ���Ҫ����ϡ����220mL���Իش��������⣺
��1������Ͳ��ȡ��Ũ����____________mL��
��2������ʱ������ʹ�õ���������Ͳ���ձ����������⣬��ȱ�ٵ�������____��
��3��������Һ�Ĺ����У�������������ȷ�����в�����ʹ������ҺŨ��ƫ�ߵ���__________��
A������Ͳ��ȡŨ����ʱ����
B��ϡ��Ũ����ʱ��δ��ȴ�����¼�ת�Ƶ�����ƿ��
C����ȡŨH2SO4�����Ͳ����ϴ�ӣ�����ϴ��Һת�Ƶ�����ƿ��
D������ҡ�Ⱥ���Һ����ڿ̶��ߣ����ý�ͷ�ιܼ�����ˮ����Һ����ʹ���̶�������
E������ƿ������
F������ʱ����������ƿ�̶���
���𰸡����� ���� ��Һ ���� 13.6 250mL����ƿ����ͷ�ι� BC
��������
I����1������ˮ�;ƾ��е㲻ͬ�ش�
��2���������Ȼ�̼�ӷ��ش�
��3��ˮ�����Ȼ�̼�������ܣ�
��4���Ȼ�����������ˮ�ij�����
II����1������c=![]() ����ŨH2SO4�����ʵ���Ũ�ȣ��ٸ�����Һϡ��ǰ�����ʵ��������������Ũ����������
����ŨH2SO4�����ʵ���Ũ�ȣ��ٸ�����Һϡ��ǰ�����ʵ��������������Ũ����������
��2����������һ�����ʵ���Ũ�ȵ���Һ�����Ʋ���ѡ��ʹ�õ�������
��3������c=![]() �жϸ�ѡ������Ƶ���ҺŨ�ȵ�Ӱ�죻
�жϸ�ѡ������Ƶ���ҺŨ�ȵ�Ӱ�죻
I����1��ˮ�;ƾ��е㲻ͬ���������룻
��2�����Ȼ�̼�ӷ����������������Ȼ�̼��
��3��ˮ�����Ȼ�̼�������ܣ��÷�Һ������ˮ�����Ȼ�̼��
��4���Ȼ�����������ˮ�ij������ù��˷�������������Һ�е��Ȼ�����
II����1��ŨH2SO4�����ʵ���Ũ��c=![]() mol/L=18.4mol/L����Ҫϡ����220mL��ʵ����û��220mL����ƿ����Ҫ��250mL����ƿ������ϡ�Ͷ��ɣ�ϡ��ǰ�����ʵ����ʵ������䣬����Ũ��������ΪxmL�����У� xmL��18.4mol/L=250mL��1mol/L����ã�x��13.6��
mol/L=18.4mol/L����Ҫϡ����220mL��ʵ����û��220mL����ƿ����Ҫ��250mL����ƿ������ϡ�Ͷ��ɣ�ϡ��ǰ�����ʵ����ʵ������䣬����Ũ��������ΪxmL�����У� xmL��18.4mol/L=250mL��1mol/L����ã�x��13.6��
��2��������Һ�IJ��������м��㡢��ȡ��ϡ�͡���Һ��ϴ����Һ�����ݡ�ҡ�ȵȲ���������Ͳ��ȡ���õ���ͷ�ιܣ�Ũ���ᣬ���ձ���ϡ�ͣ��ò��������裬��ȴ��ת�Ƶ�����ƿ�У����ò�����������ϴ��2��3�Σ���ϴ��Һת�Ƶ�����ƿ�У���ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�����ݵߵ�ҡ�ȣ����ṩ��������֪����Ҫ������250mL����ƿ����ͷ�ιܣ�
��3��A����ȡŨ����ʱ�����Ӷ�����������ȡ��Ũ�������ƫС�����Ƶ���Һ�����ʵ����ʵ���ƫС����ҺŨ��ƫ�ͣ��ʲ�ѡA��
B��ϡ��Ũ����ʱ��δ��ȴ�����¼�ת�Ƶ�����ƿ�У�����������Һ���ƫС����ҺŨ��ƫ�ߣ���ѡB��
C��ϴ����ȡŨH2SO4�����Ͳ������ϴ��Һת�Ƶ�����ƿ�У��������Ƶ���Һ�����ʵ����ʵ���ƫ����ҺŨ��ƫ�ߣ���ѡC��
D������ҡ�Ⱥ���Һ����ڿ̶��ߣ����ý�ͷ�ιܼ�����ˮ����Һ����ʹ���̶������У��������Ƶ���Һ���ƫ�����Ƶ���ҺŨ��ƫ�ͣ��ʲ�ѡD��
E������ƿ��������ڶ��ݻ���Ҫ��������ˮ�����Բ�Ӱ�����ƽ�����ʲ�ѡF��
F������ʱ����������ƿ�̶��ߣ�����������Һ���ƫ����ҺŨ��ƫ�ͣ��ʲ�ѡF��
�ʴ�ѡBC��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�