题目内容
【题目】在体积为2 L的恒容密闭容器中发生反应:xA(g)+yB(g) ![]() zC(g),图1表示200 ℃时容器中A、B、C物质的量随时间的变化关系,图2表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g),图1表示200 ℃时容器中A、B、C物质的量随时间的变化关系,图2表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
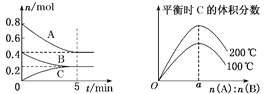
图1 图2
A.反应xA(g)+yB(g) ![]() zC(g)的ΔH>0,且a=2
zC(g)的ΔH>0,且a=2
B.200 ℃时,反应从开始到平衡的平均速率υ(B)=0.04 mol·L-1·min-1
C.若在图1所示的平衡状态下,再向体系中充入He,此时υ(正)>υ(逆)
D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数小于0.5
【答案】AD
【解析】
A.由图2可知:升高温度,平衡时C的体积分数增大,说明升高温度化学平衡向正反应方向移动,根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,正反应方向为吸热反应,所以△H>0。根据图1所示可知相同时间内转化的A、B、C物质的量之比为2:1:1,该反应的方程式为2A(g)+B(g)![]() C(g),只有当两种反应物按照方程式的计量数之比加入时生成物C达到平衡时含量才会最高,故a=2,选项A正确;
C(g),只有当两种反应物按照方程式的计量数之比加入时生成物C达到平衡时含量才会最高,故a=2,选项A正确;
B.200℃时,反应从开始到平衡的平均速率υ(B)=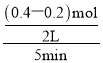 =0. 02 mol/(L·min),选项B错误;
=0. 02 mol/(L·min),选项B错误;
C.若在图1所示的平衡状态下,再向体系中充入He,由于平衡混合物中各组分的浓度没变,所以平衡不移动,υ(正)=υ(逆),选项C错误;
D.由图1可知在200℃时,若加入0.8mol A和0.4mol B,达到平衡时A的含量为0.5,若向容器中充入2 mol A 和1 mol B,即增大了反应物的浓度,相当于增大压强,根据平衡移动原理:增大压强,化学平衡向正反应方向移动,所以达到平衡时,A 的体积分数小于0.5,选项D正确;
答案选AD。

【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)。各容器中起始物质的量浓度与反应温度如下表所示:
N2(g)+2CO2(g)。各容器中起始物质的量浓度与反应温度如下表所示:
容器 | 温度/℃ | 起始物质的量浓度/(mol·L-1) | |||
NO(g) | CO(g) | N2 | CO2 | ||
甲 | T1 | 0.10 | 0.10 | 0 | 0 |
乙 | T2 | 0 | 0 | 0.10 | 0.20 |
丙 | T2 | 0.10 | 0.10 | 0 | 0 |
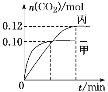
反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示。下列说法正确的是
A.该反应的正反应为放热反应,平衡常数K(T1)<K(T2)
B.乙容器中反应达到平衡时,N2的转化率小于40%
C.达到平衡时,乙容器中的压强一定大于甲容器的2倍
D.丙容器中反应达到平衡后,再充入0.10 mol NO和0.10 mol CO2,此时υ(正)<υ(逆)