题目内容
【题目】草酸是一种酸,草酸晶体(H2C2O42H2O)易溶于水,熔点较低,加热会熔化、气化和分解。草酸(H2C2O4)与氢氧化钙的反应:H2C2O4+Ca(OH)2=CaC2O4↓(白色)+2H2O。
(1)草酸的水溶液的pH___7(填“>”、“=”、“<”)
(2)实验室可用加热草酸晶体分解的方法获得CO。
①先加热草酸晶体生成CO、CO2和H2O,其化学方程式是____;
②最后用图1装置收集CO,气体应从___端进入(选填“a”或“b”)。
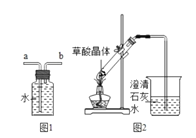
(3)实验图2中观察到澄清石灰水变浑浊,乙认为一定是由草酸晶体受热分解产生的CO2所导致,丙认为乙的结论不严密,理由是___。
按图3装置将草酸钙晶体(H2C2O4xH2O)样品高温加热,使其完全分解。

(4)B中观察到硫酸铜变蓝,说明反应生成了_____;
(5)C、G中澄清石灰水均变浑浊,说明反应还生成___和___气体。
(6)反应开始前通入氮气的目的是____。
【答案】< H2C2O42H2O ![]() CO↑+CO2↑+3H2O↑ b 草酸加热气化产生草酸(H2C2O4)蒸气与氢氧化钙反应生成CaC2O4沉淀 水 一氧化碳 二氧化碳 排尽装置内的空气或除去装置中的水、二氧化碳和氧气
CO↑+CO2↑+3H2O↑ b 草酸加热气化产生草酸(H2C2O4)蒸气与氢氧化钙反应生成CaC2O4沉淀 水 一氧化碳 二氧化碳 排尽装置内的空气或除去装置中的水、二氧化碳和氧气
【解析】
(1)草酸的水溶液的pH<7,因其水溶液显酸性;
(2)①先加热草酸晶体生成CO、CO2和H2O,其化学方程式是H2C2O42H2O ![]() CO↑+CO2↑+3H2O↑;
CO↑+CO2↑+3H2O↑;
②CO难溶于水,相当于排水集气,因此气体应从b端进入;
(3)由题干叙述可知草酸易气化,可知草酸加热气化产生草酸(H2C2O4)蒸气与氢氧化钙反应生成CaC2O4沉淀;
(4)B中观察到硫酸铜粉末变蓝,说明反应生成了水;
(5)C中澄清石灰水均变浑浊,说明反应产生二氧化碳,G中澄清石灰水变浑浊,说明反应生成一氧化碳,一氧化碳又被氧化铜氧化为二氧化碳,从而变浑浊;
(6)由于装置中含有空气,则反应开始前通入氮气的目的是排尽装置内的空气或除去装置中的水、二氧化碳和氧气。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案【题目】氮氧化物是评价空气质量的控制标准之一,作为空气污染物的氮氧化物(NOx)常指NO和NO2。
(1)下列关于氮氧化物有关叙述不正确的是:_______(填序号)
①对人体及动物有毒害作用;②造成土壤污染;③一氧化氮可结合血红蛋白造成人体缺氧;④是形成酸雨、酸雾的主要原因之一; ⑤增高大气温度;⑥与碳氢化合物形成光化学烟雾;⑦参与臭氧层的破坏;⑧一氧化氮分子作为一种传递神经信息的 信使分子 ,在使血管扩张,免疫,增强记忆力
(2)用CH4催化还原NOx可在一定程度上消除氮氧化物的污染。
已知:CH4(g)+4NO(g) ![]() 2N2(g)+CO2(g)+2H2O(g)的ΔH=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)的ΔH=-1160kJ·mol-1
2NO2(g)+N2(g) ![]() 4NO(g) ΔH=+293 kJ·mol-1
4NO(g) ΔH=+293 kJ·mol-1
则该条件下,CH4催化还原NO2消除污染的热化学方程式为_______________。
(3)T1℃时,在刚性反应器中以投料比为1:3的NO(g)与O2(g)反应,其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,NO(g)完全反应]。
t/min | 0 | 40 | 80 | 160 | 260 | 700 | ∞ |
p/kPa | 32.8 | 30.7 | 29.9 | 29.4 | 29.2 | 28.8 | 26.9 |
①NO(g)与O2(g)合成的反应速率v=4.2×10-2×p2(NO)×p(O2)(kPa·min-1),t=42 min时,测得体系中p(O2)=22.4 kPa,则此时的v=_________kPa·min-1(计算结果保留1位小数)。
②若降低反应温度至T2℃,则NO(g)与O2(g)完全反应后体系压强p∞(T2℃)_________(填“大于”“等于”或“小于”)26.9kPa,原因是___________________________________。
③T1℃时,反应N2O4(g) ![]() 2NO2(g)的平衡常数Kp=___kPa(Kp为以分压表示的平衡常数,是指平衡时体系中生成气体压强幂之积与反应物气体压强幂之积的比值。计算结果保留3位小数)。
2NO2(g)的平衡常数Kp=___kPa(Kp为以分压表示的平衡常数,是指平衡时体系中生成气体压强幂之积与反应物气体压强幂之积的比值。计算结果保留3位小数)。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(两者物质的量之比为1:1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。

①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:______________。


