题目内容
已知下列热化学方程式
Zn(s)+  O2(g)====ZnO(s) ΔH1="-351.1"
kJ·mol-1
O2(g)====ZnO(s) ΔH1="-351.1"
kJ·mol-1
Hg(l)+  O2(g) ====HgO(s) ΔH2="-90.7"
kJ·mol-1
O2(g) ====HgO(s) ΔH2="-90.7"
kJ·mol-1
由此可知Zn(s)+HgO(s) ====ZnO(s)+Hg(l) ΔH3。其中ΔH3的值是( )
A.-441.8 kJ·mol-1 B.-254.6 kJ·mol-1
C.-438.9 kJ·mol-1 D.-260.4 kJ·mol-1
【答案】
D
【解析】
试题分析:先将Hg(l)+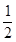 O2(g) ====HgO(s)倒过来,得HgO(s) ="===Hg(l)+"
O2(g) ====HgO(s)倒过来,得HgO(s) ="===Hg(l)+" 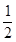 O2(g);ΔH′2="+90.7"
kJ·mol-1
O2(g);ΔH′2="+90.7"
kJ·mol-1
再加上Zn(s)+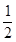 O2(g) ====ZnO(s) ΔH1="-351.1"
kJ·mol-1
O2(g) ====ZnO(s) ΔH1="-351.1"
kJ·mol-1
即得Zn(s)+HgO(s) ====ZnO(s)+Hg(l) ΔH3=ΔH1+ΔH′2="-260.4" kJ·mol-1
所以正确的答案选D。
考点:考查反应热的计算和盖斯定律的应用
点评:该题是高考中的常见题型,也是重要的考点之一。试题基础性强,解决高考,有助于培养学生的逻辑思维能力。该题的关键是明确盖斯定律的含义,即一个化学反应不管分几步进行,反应焓变是一样的,焓变是各步反应焓变的代数和。

练习册系列答案
相关题目
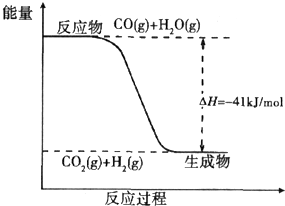 煤炭可以转化为清洁能源和化工原料.
煤炭可以转化为清洁能源和化工原料.