题目内容
5.将硫酸铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,则原硫酸铝溶液和氢氧化钠溶液的物质的量浓度之比可能是( )①1:3 ②2:3 ③1:7 ④2:7 ⑤任意比.
| A. | 只有① | B. | ①③ | C. | ②③ | D. | ②④ |
分析 将硫酸铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,沉淀为Al(OH)3,溶液中的铝元素存在形式可能为Al2(SO4)3或NaAlO2,令氢氧化铝为1mol,根据Al元素守恒计算Al2(SO4)3的物质的量,结合反应:Al3++3OH-═Al(OH)3↓、Al3++4OH-=AlO2-+2H2O,讨论进行计算氢氧化钠的物质的量.
解答 解:等体积的AlCl3和NaOH两种溶液混合后,沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,令氢氧化铝的物质的量为1mol,则溶液中Al2(SO4)3为0.5mol或NaAlO2是1mol,原溶液中Al2(SO4)3的物质的量为0.5mol+0.5mol=1mol,
若溶液中含铝元素以Al3+形式存在,NaOH完全反应,则:
Al3++3OH-═Al(OH)3
1mol 3mol 1mol
则NaOH为3mol,则Al2(SO4)3和NaOH两种溶液物质的量浓度之比=1mol:3mol=1:3,
若溶液中含铝元素以AlO2-形式存在,则:
Al3++3OH-═Al(OH)3
1mol 3mol 1mol
Al3++4OH-═AlO2-+2H2O,
1mol 4mol 1mol
则NaOH为3mol+4mol=7mol,则Al2(SO4)3和NaOH两种溶液物质的量浓度之比=1mol:7mol=1:7,
故选:B.
点评 本题考查化学方程式有关计算,判断溶液中Al元素存在形式是关键,再结合方程式计算,难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
15.2010年世界环境日,中国的主题是:低碳减排,绿色生活”号召公众从我做起,推进污染减排,践行绿色生活,为建设生态文明、构建环境友好型社会贡献力量.下列有关做法不符合这一要求的是( )
| A. | 在大力推广乙醇汽油的同时,研究开发太阳能电池和氢燃料电池汽车 | |
| B. | 大力发展农村沼气,将废弃的农作物秸秆转化为清洁、高效的能源 | |
| C. | 研发高效低毒农药,降低蔬菜的农药残留量 | |
| D. | 以聚苯乙烯全面代替木材,生产包装盒、快餐盒等以减少木材的使用,保护森林 |
16.下列说法错误的是( )
| A. | 电解饱和食盐水可制取烧碱、氯气、氢气 | |
| B. | 粗铜(含少量Zn、Fe、Pt等)电解精炼后,溶液中金属阳离子只有Fe2+、Zn2+ | |
| C. | 以海水为原料可提取镁、溴、碘等物质 | |
| D. | 在镀件上镀铜,镀件作阴极 |
13.下列叙述正确的是( )
| A. | NaHCO3与石灰水反应,当n(NaHCO3):n[Ca(OH)2]=3:1时,溶液中无HCO3- | |
| B. | CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=1:1时,能得到澄清溶液 | |
| C. | 将金属钠投入硫酸铜溶液中可观察到有红色的铜生成 | |
| D. | 硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
20.有关如图及实验的描述正确的是( )
| A. |  用图装置蒸发FeCl3溶液制备无水FeCl3 用图装置蒸发FeCl3溶液制备无水FeCl3 | |
| B. |  用图装置电解精炼铝 用图装置电解精炼铝 | |
| C. | 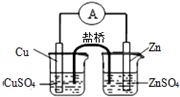 用图装置构成铜锌原电池 用图装置构成铜锌原电池 | |
| D. |  用图装置定量测定化学反应速率 用图装置定量测定化学反应速率 |
10.酸性溶液中离子还原性强弱为:SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是( )
| A. | 2Fe3++2H2O+SO2═2Fe2++SO42-+4H+ | B. | 2Fe2++Cl2═2Fe3++2Cl- | ||
| C. | I2+SO2+2H2O═H2SO4+2HI | D. | H2O2+H2SO4═SO2↑+O2↑+2H2O |
6.下列各组混合物中,不论二者以什么比例混合,只要总质量一定,完全燃烧时生成CO2的质量也一定,不符合上述要求的是( )
| A. | 苯、甲苯 | B. | 乙炔、苯乙烯 | C. | 甲醛、甲酸甲酯 | D. | 乙烯、环己烷 |
 A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去).
A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去).