题目内容
【题目】25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如下图所示。下列有关溶液中离子浓度关系叙述正确的是( )
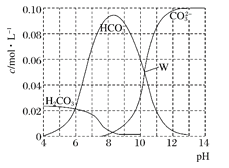
A. W点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)
B. pH=4的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)<0.1mol·L-1
C. pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-)
D. pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3)
【答案】B
【解析】试题分析:A、W点所示的溶液呈电中性,即c(正电荷) = c(负电荷),则c(Na+) + c(H+) =" 2" c(CO32-) + c(HCO3-) + c(OH-) + c(Cl-),不能漏了碳酸氢根离子所带负电荷浓度,A错误;B、由物料守恒原理可知,c(H2CO3) + c(HCO3-) + c(CO32-) + c(CO2) =" 0.1" mol·L-1,由于饱和碳酸的pH=5.6,则pH = 4的溶液中已经逸出部分CO2,则c(H2CO3) + c(HCO3-) + c(CO32-) < 0.1 mol·L-1,B正确;C、由电荷守恒原理可得:c(Na+) + c(H+) =" 2" c(CO32-) + c(HCO3-) + c(OH-) + c(Cl-),由物料守恒原理可得:c(Na+) =" 2" c(H2CO3) + 2 c(HCO3-) + 2 c(CO32-),则2 c(H2CO3) + 2 c(HCO3-) + 2 c(CO32-) + c(H+) =" 2" c(CO32-) + c(HCO3-) + c(OH-) + c(Cl-),即2 c(H2CO3) + c(HCO3-) + c(H+) = c(OH-) + c(Cl-),不能漏了H2CO3浓度的2倍,C错误;D、根据图像可知pH=11时,Na2CO3的浓度远远大于NaHCO3,说明反应Na2CO3+HCl=NaCl+NaHCO3中参加反应的Na2CO3较少,过量的Na2CO3较多,由过量的Na2CO3及等量NaCl、NaHCO3的电离及NaHCO3的水解规律可知,c(Na+) > c(CO32-) > c(Cl-) > c(HCO3-) > c(H2CO3),D错误;答案选B。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案

