题目内容
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
I.汽车内燃机工作时会引起N2和O2的反应:N2+O2![]() 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。
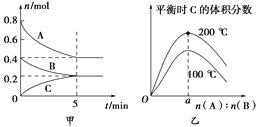
(1)在T1、T2温度下,一定量的NO发生分解反应时N2 的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+O2(g)![]() 2NO(g)的△H__________0(填“>"或“ <”)。
2NO(g)的△H__________0(填“>"或“ <”)。

(2)在T3温度下,向2L密闭容器中充入10molN2与5molO2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N2)_________。该温度下,若增大压强此反应的平衡常数将____________(填“增大”、“减小”、“不变”或“无法确记”);若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后O2的转化率为__________。
II.甲烷和甲醇可以做燃料电池,具有广阔的开发和应用前景,回答下列问题
(3)甲醇燃料电池(简称DMFC )由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如右图所示:
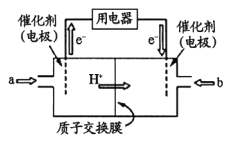
通入a气体的电极是原电池的____________极(填“正”或“负”),其电极反应式为_______________。
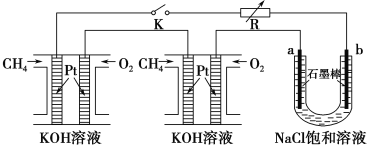
(4)某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示U形管中氯化钠溶液的体积为800ml。闭合K后,若每个电池甲烷用量为0.224L (标况),且反应完全,则理论上通过电解池的电量为 __________(法拉第常数F=9.65×104C/mol),若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为_________。
【答案】(1) > (2) 0.01mol/(L.s) 不变 14.3%
(3) 负 CH3OH-6e-+H2O=CO2+6H+
(4)7.72×103 c(5)13
【解析】
试题分析:(1)根据题给图像知,温度为T2时先达到平衡状态,说明温度为T2时反应速率快,故温度:T1<T2,但温度为T2时反应达平衡时氮气的体积分数低,说明升高温度平衡向正反应方向进行,正方应是吸热反应,即△H>0。
(2)50秒后达到平衡,测得NO的物质的量为2mol,根据方程式可知消耗氮气是1mol,则该反应的速率v(N2)根据公式v=△n/V△t将题给数据代入计算得υ(N2)=![]() =0.01 mol·L-1·s-1;平衡常数只与温度有关系,增大压强平衡常数不变;平衡时氮气和氧气的浓度分别是5mol/L-0.5mol/L=4.5mol/L、2.5mol/L-0.5mol/L=2mol/L,NO的浓度是1mol/L,T3温度下该反应的化学平衡常数K=1/9,如果该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则
=0.01 mol·L-1·s-1;平衡常数只与温度有关系,增大压强平衡常数不变;平衡时氮气和氧气的浓度分别是5mol/L-0.5mol/L=4.5mol/L、2.5mol/L-0.5mol/L=2mol/L,NO的浓度是1mol/L,T3温度下该反应的化学平衡常数K=1/9,如果该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则
N2 (g) + O2(g)![]() 2NO(g)
2NO(g)
起始浓度(mol/L) 0.5 0.5 0
转化浓度(mol/L) x x 2x
平衡浓度(mol/L) 0.5-x 0.5-x 2x
因此平衡常数K=![]() =1/9,解得x=1/14,因此达到平衡后N2的转化率为14.3%;
=1/9,解得x=1/14,因此达到平衡后N2的转化率为14.3%;
(3)燃料电池中,通入燃料的电极为负极,发生氧化反应。根据装置图可知左侧是电子流出的一极,所以通入a气体的电极是原电池的负极。由于存在质子交换膜,所以甲醇被氧化生成二氧化碳,电极方程式为CH3OH-6e-+H2O=CO2+6H+;
(4)电解氯化钠溶液的化学方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,可知关系式1 mol CH4~8 mol e﹣~8molNaOH,故若每个电池甲烷通入量为0.224L(标准状况),生成0.08molNaOH,c(NaOH)=0.08mol÷0.8L=0.1mol/L,pH=13;电解池通过的电量为
2NaOH+H2↑+Cl2↑,可知关系式1 mol CH4~8 mol e﹣~8molNaOH,故若每个电池甲烷通入量为0.224L(标准状况),生成0.08molNaOH,c(NaOH)=0.08mol÷0.8L=0.1mol/L,pH=13;电解池通过的电量为![]() ×8×9.65×104Cmol﹣1=7.72×103C(题中虽然有两个燃料电池,但电子的传递量只能用一个池的甲烷量计算。
×8×9.65×104Cmol﹣1=7.72×103C(题中虽然有两个燃料电池,但电子的传递量只能用一个池的甲烷量计算。

 阅读快车系列答案
阅读快车系列答案