题目内容
【题目】已知某物质X 能发生如图转化(四种物质均含元素R ) ,回答下列问题:
![]()
Ⅰ.已知X是一种能使湿润的红色石蕊试纸变蓝的气体,与A化合生成一种正盐,则:
(1)X的电子式为______,写出X与Z在催化剂作用下生成两种无毒物质的化学方程式_____。
(2)在含Cu2+离子溶液中,RO2-离子可转化为RO,写出Cu+和RO2-离子在酸性水溶液中反应的离子方程式___________。
Ⅱ.若X的产量是衡量一个国家石油化工水平的标志,且Y与A在浓硫酸作用下生成一种具有香味的物质B, 则:
(1)X的分子式为________,①的反应类型是_______,工业上以X为为原料可以合成一种生活中最常见的有机高分子材料,其反应的化学方程式为__________。
(2)实验室利用Y与A制备B,写出化学反应方程式:________,实验中配制一定比例的Y、A和浓硫酸的混合液的方法(加入试剂的顺序)是:_________。
【答案】 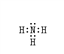 8NH3+6NO2 =7N2 +12H2O Cu++NO2-+2H+=Cu2++NO↑+H2O C2H4 加成反应
8NH3+6NO2 =7N2 +12H2O Cu++NO2-+2H+=Cu2++NO↑+H2O C2H4 加成反应 ![]() CH3COOH+CH3CH2OH
CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 先加人乙醇,再加入浓硫酸,最后加入乙酸(只要浓硫酸后加都给分)
CH3COOCH2CH3+H2O 先加人乙醇,再加入浓硫酸,最后加入乙酸(只要浓硫酸后加都给分)
【解析】Ⅰ. (1)X是一种能使湿润的红色石蕊试纸变蓝的气体,为氨气,氨气分子中氮原子和每个H原子之间都存在一对共用电子对,且N原子还有一个孤电子对,所以氨气电子式为![]() ;NO2具有强氧化性,NH3有强还原性,二者相遇,会发生反应产生氮气和水,根据电子守恒、原子守恒,可得反应的方程式:8NH3+6NO2 =7N2 +12H2O。
;NO2具有强氧化性,NH3有强还原性,二者相遇,会发生反应产生氮气和水,根据电子守恒、原子守恒,可得反应的方程式:8NH3+6NO2 =7N2 +12H2O。
(2) Cu+和亚硝酸根离子在酸性水溶液中反应,亚硝酸根 (NO2-)离子可转化为NO,Cu+被氧化为铜离子,离子方程式Cu++NO2-+2H+=Cu2++NO↑+H2O。Ⅱ.由X的产量是衡量一个国家石油化工水平的标志,且Y与A在浓硫酸作用下生成一种具有香味的物质B,结合转化关系可知X为乙烯、Y为乙醇,Z为乙醛,A为乙酸、B是乙酸乙酯。(1)乙烯与水发生加成反应生成乙醇,乙烯含有碳碳双键,能够发生加聚反应生成高分子化合物聚乙烯;(2)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,同时该反应可逆,反应的化学方程式为CH3COOH+CH3CH2OH![]() CH3COOC2H5+H2O;制取乙酸乙酯时,先加人乙酸和乙醇,再加入浓硫酸,防止混合液体溅出,发生危险。
CH3COOC2H5+H2O;制取乙酸乙酯时,先加人乙酸和乙醇,再加入浓硫酸,防止混合液体溅出,发生危险。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案【题目】用生石灰(CaO)、纯碱(Na2CO3)和食盐(NaCl)按一定比例混合可制得一种腌制原料,某同学为了探究该原料成份做了以下实验:
该同学取一定量的样品溶于水,主要发生的化学方程式有:____________________________, _____________________________________。
(2)该同学认为(1)过滤后所得的滤液中肯定含有大量的NaOH、NaCl溶质,还可能含有Ca(OH)2或Na2CO3 ,为了探究所得滤液中可能含有的物质是否存在,请你帮他完善实验方案。
实验方案设计如下表所示:
实 验 步 骤 | 实 验 现 象 | 实 验 结 论 | 用离子方程式解释 |
①取少量滤液,滴加适量K2CO3溶液 | 若出现白色沉淀 | 滤液中含Ca(OH)2 | Ⅰ:________________ |
若无白色沉淀 | 滤液中无Ca(OH)2 |
| |
②取少量滤液,______________________________________________ | ⅰ:若出___________ | 滤液中含Na2CO3 | Ⅱ:_______________ |
ⅱ:若无___________ | 滤液中无Na2CO3 |
|
【题目】下列分离和提纯的实验中,所选用的方法或仪器不正确的是( )
序号 | A | B | C | D |
实验目的 | 分离食盐水与泥沙 | 分离水和CCl4 | 制取蒸馏水 | 从浓食盐水中得到氯化钠晶体 |
分离方法 | 过滤 | 萃取 | 蒸馏 | 蒸发 |
选用仪器 |
|
|
|
|
A. A B. B C. C D. D



