题目内容
下列物质中,所含的原子或离子中最外层都为8电子结构的是( )
| A、NO2 |
| B、K2S |
| C、LiCl |
| D、CHCl3 |
考点:化学键,原子核外电子排布
专题:化学键与晶体结构
分析:在ABn型化合物中,中心元素A的族序数+成键数=8时,满足分子中所有原子都满足最外层8电子结构,含H元素的化合物一定不满足,以此来解答.
解答:
解:A.N元素最外层为5个电子,NO2中N原子最外层为9个电子,故A错误;
B.K2S为离子化合物,K原子失去一个电子后,次外层变成最外层,是8个电子,S原子得到2个电子变为最外层8电子,故B正确;
C.LiCl为离子化合物,Li原子失去一个电子后,次外层变成最外层,是2个电子,故C错误;
D.CHCl3中H原子最外层为2个电子,胡D错误.
故选B.
B.K2S为离子化合物,K原子失去一个电子后,次外层变成最外层,是8个电子,S原子得到2个电子变为最外层8电子,故B正确;
C.LiCl为离子化合物,Li原子失去一个电子后,次外层变成最外层,是2个电子,故C错误;
D.CHCl3中H原子最外层为2个电子,胡D错误.
故选B.
点评:本题考查最外层8电子结构,注意分子中所有原子,则含有H原子的化合物一定不满足,并学会利用规律来解答.

练习册系列答案
相关题目
下列物质既属于钾盐又属于硫酸盐的是( )
| A、Na2CO3 |
| B、Na2SO4 |
| C、K2SO4 |
| D、NaHCO3 |
下列离子可以大量共存的是( )
| A、K+、SO42-、OH-、Cl- |
| B、Na+、Ag+、Cl-、NO3- |
| C、Ba2+、Na+、OH-、CO32- |
| D、Na+、NH4+、NO3-、OH- |
向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~t1阶段c(B)未画出].附图乙为t2时刻后改变条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件(所用条件均不同).已知t3~t4阶段使用催化剂.下列说法正确的是( )
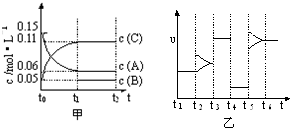

| A、t2~t3阶段的一定是增加反应物浓度 |
| B、t4~t5阶段改变的条件为降温或减压 |
| C、B的起始物质的量为0.02mol |
| D、该反应的化学方程式为:3A(g)?B(g)+2C(g) |
下列有关说法正确的是( )
| A、水中存在电离平衡,向纯水中加酸或加入碱都抑制水的电离,加盐可以促进水的电离 |
| B、将0.2mol/L的NH3?H2O与0.1mol/L的HCl溶液等体积混合,则c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、常温下,0.1mol/L的NaHCO3溶液中,c(Na+)+c(H+)═c(OH-)+c(HCO3-)+2c(CO32-) |
| D、在25℃时,除去水体中的Ba2+选择Na2CO3比Na2CrO4好[已知Ksp(BaCO3)>Ksp(BaCrO4)] |
下列有关化学实验的说法正确的是( )
| A、除去NO气体中的NO2气体,把混合气体通过盛有水的洗气瓶 |
| B、把氯气通入石蕊试液中和把二氧化硫通入石蕊试液中的现象相同:先变红后褪色 |
| C、鉴别碳酸钠溶液和碳酸氢钠溶液可以用澄清石灰水 |
| D、工业上制取金属铝和金属镁都是电解熔融的二者的氯化物 |
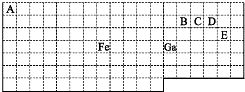 如图中实线是元素周期表的部分边界,其中上边界并未用实线标出.根据信息回答下列问题.
如图中实线是元素周期表的部分边界,其中上边界并未用实线标出.根据信息回答下列问题.