题目内容
3.现有A、B、C三种烃某球棍模型如图: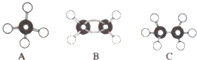
(1)A的空间构型为正四面体;C的名称为乙烷
(2)下列能鉴别A和B的试剂是bd(填序号)
a.稀硫酸 b.溴的四氯化碳溶液 c.水 d.酸性高锰酸钾溶液
(3)若以B为主要原料合成乙酸,其合成线路如图所示
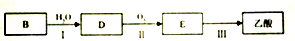
①乙酸中的官能团名称为羧基
②反应Ⅱ的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,其反应类型为氧化反应
(4)工业上以B为原料可以合成一种重要的有机高分子化合物,该化合物的结构简式为
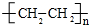
(5)在120℃、1.01×105Pa时,A、B、C三种烃分别和足量的氧气充分燃烧,相同条件下测得反应前后总体积没有发生变化的是AB(填序号)
分析 (1)(2)由烃的结构模型可知,A为CH4、B为CH2=CH2、C为CH3CH3;
(3)乙烯与水在一定条件下发生加成反应生成D为CH3CH2OH,乙醇在Cu或Ag作催化剂条件下发生氧化反应E为CH3CHO,CH3CHO进一步氧化生成CH3COOH;
(4)乙烯发生加聚反应生成聚乙烯;
(5)烃燃烧通式为:CxHy+(x+$\frac{y}{4}$)O2=xCO2+$\frac{y}{2}$H2O(g),相同条件下测得反应前后总体积没有发生变化,则反应前后气体的化学计量数之和相等,可得当烃分子中含有4个氢原子时,该烃完全燃烧前后气体体积不变.
解答 解:由烃的结构模型可知,A为CH4、B为CH2=CH2、C为CH3CH3.
(1)由烃的结构模型可知,A为CH4,为正四面体构型,C为CH3CH3,名称为乙烷,
故答案为:正四面体;乙烷;
(2)乙烯含有碳碳双键,能与溴发生加成反应,能被酸性高锰酸钾溶液氧化,是溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,乙烷不能,可以鉴别二者,
故答案为:bd;
(3)乙烯与水在一定条件下发生加成反应生成D为CH3CH2OH,乙醇在Cu或Ag作催化剂条件下发生氧化反应E为CH3CHO,CH3CHO进一步氧化生成CH3COOH,
①乙酸中的官能团名称为:羧基,故答案为:羧基;
②反应Ⅱ的化学方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,属于氧化反应,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,氧化反应;
(4)乙烯发生加聚反应生成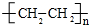 ,故答案为:
,故答案为: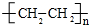 ;
;
(5)烃燃烧通式为:CxHy+(x+$\frac{y}{4}$)O2=xCO2+$\frac{y}{2}$H2O(g),相同条件下测得反应前后总体积没有发生变化,则1+(x+$\frac{y}{4}$)=x+$\frac{y}{2}$,整理可得y=4,即当烃分子中含有4个氢原子时,该烃完全燃烧前后气体体积不变,故甲烷、乙烯符合,故选:AB.
点评 本题考查学生有机物的结构与性质、化学方程式有关计算等,侧重对基础知识的巩固,难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 丙烯 | B. | 2,3一二甲基-2-丁烯 | ||
| C. | 2-甲基-2-丁烯 | D. | 1-氯-1-丙烯 |
| A. | A2BC3 | B. | A4BC4 | C. | ABC4 | D. | A4B2C2 |
| A. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O | |
| B. | 将标准状况下1.12L氯气通入10mL 1mol•L-1的溴化亚铁溶液中:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 | |
| C. | 氢氧化铁溶于氢碘酸溶液:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | 4mol•L-1的NaAlO2溶液和7mol•L-1的盐酸等体积混合:AlO2-+4H+=Al3++2H2O |
| A. | 硅是构成一些岩石和矿物的基本元素,单质硅是良好的半导体材料 | |
| B. | 水泥、玻璃、水晶饰物都硅酸盐制品 | |
| C. | 玻璃是氧化物,成分可表示为Na2O•CaO•6SiO2 | |
| D. | 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂等的原料 |
| A. | 单质 | B. | 元素 | C. | 原子 | D. | 分子 |