题目内容
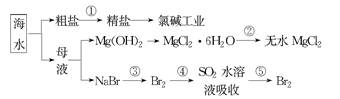
海南省是海洋大省,海水是一种丰富的资源,工业上从海水中可提取许多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。
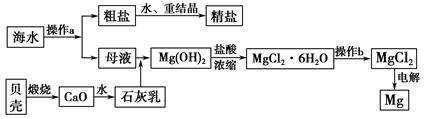
回答下列问题:
(1)流程图中操作a的名称为_________________________________________。
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①则气体A应是_______________(填化学式),其过程反应方程式为_______________________________。
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品NH4Cl晶体,则通入NH3的作用是_______________________________________________。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。操作b是在__________气氛中进行,若在空气中加热,则会水解生成Mg(OH)Cl,写出有关反应的化学方程式_________________________________________。
(4)一氯碱厂每天消耗234吨NaCl,这些NaCl能生产质量分数为32%的烧碱溶液__________吨,同时转移__________mol电子。

回答下列问题:
(1)流程图中操作a的名称为_________________________________________。
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①则气体A应是_______________(填化学式),其过程反应方程式为_______________________________。
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品NH4Cl晶体,则通入NH3的作用是_______________________________________________。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。操作b是在__________气氛中进行,若在空气中加热,则会水解生成Mg(OH)Cl,写出有关反应的化学方程式_________________________________________。
(4)一氯碱厂每天消耗234吨NaCl,这些NaCl能生产质量分数为32%的烧碱溶液__________吨,同时转移__________mol电子。
(1)蒸发结晶
(2)①NH3 NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl(或NH3+CO2+H2O=NH4HCO3、NH4HCO3+NaCl=NaHCO3↓+NH4Cl)
②增大NH4+的浓度,有利于平衡向生成NH4Cl的方向进行,将NaHCO3转化为Na2CO3而不析出
(3)①HCl(或氯化氢) MgCl2·6H2O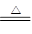 Mg(OH)Cl+HCl↑+5H2O
Mg(OH)Cl+HCl↑+5H2O
(4)500 4×106
(2)①NH3 NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl(或NH3+CO2+H2O=NH4HCO3、NH4HCO3+NaCl=NaHCO3↓+NH4Cl)
②增大NH4+的浓度,有利于平衡向生成NH4Cl的方向进行,将NaHCO3转化为Na2CO3而不析出
(3)①HCl(或氯化氢) MgCl2·6H2O
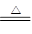 Mg(OH)Cl+HCl↑+5H2O
Mg(OH)Cl+HCl↑+5H2O(4)500 4×106
(1)海水中食盐的制取用蒸发结晶,利用太阳能晒盐。
(2)食盐制备纯碱的方法为侯德榜制碱法,利用碳酸氢钠的溶解度较小,生成碳酸氢钠固体,过滤后加热,利用其分解得到碳酸钠。
(3)MgCl2·6H2O受热时Mg2+发生水解反应生成HCl,为防止其水解的发生就要抑制其水解,根据平衡移动原理,在加热时通入HCl抑制其水解。
(4)根据化学反应方程式,NaCl的物质的量等于NaOH的物质的量,所以NaOH的质量为(234×106 g÷58.5 g·mol-1)×40 g·mol-1,则可生产质量分数为32%的烧碱溶液为500吨。电解NaCl溶液时,n(e-)=n(NaOH),即n(e-)=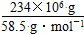 =4×106 mol。
=4×106 mol。
(2)食盐制备纯碱的方法为侯德榜制碱法,利用碳酸氢钠的溶解度较小,生成碳酸氢钠固体,过滤后加热,利用其分解得到碳酸钠。
(3)MgCl2·6H2O受热时Mg2+发生水解反应生成HCl,为防止其水解的发生就要抑制其水解,根据平衡移动原理,在加热时通入HCl抑制其水解。
(4)根据化学反应方程式,NaCl的物质的量等于NaOH的物质的量,所以NaOH的质量为(234×106 g÷58.5 g·mol-1)×40 g·mol-1,则可生产质量分数为32%的烧碱溶液为500吨。电解NaCl溶液时,n(e-)=n(NaOH),即n(e-)=
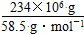 =4×106 mol。
=4×106 mol。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
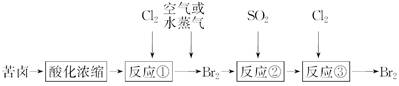
 Ti+2MgCl2获得海绵状钛。该反应在下列哪种环境中进行_______ (填序号)。
Ti+2MgCl2获得海绵状钛。该反应在下列哪种环境中进行_______ (填序号)。