题目内容
【题目】三氯胺(NCl3)是一种饮用水二级消毒剂,可由以下反应制备:
Ⅰ.![]()
![]()
回答下列问题:
(1)已知:Ⅱ.![]()
![]()
Ⅲ.![]()
![]()
则![]() =________(用含
=________(用含![]() 和
和![]() 的代数式表示)。
的代数式表示)。
(2)向容积均为2L的甲乙两个恒温密闭容器中分别加入4mol NH3和4mol Cl2,发生反应Ⅰ,测得两容器中n(Cl2)随反应时间的变化情况如下表所示:
时间/min | 0 | 40 | 80 | 120 | 160 |
容器甲(T1) | 4.0 | 3.0 | 2.2 | 1.6 | 1.6 |
容器乙(T2) | 4.0 | 2.9 | 2.0 | 2.0 | 2.0 |
①0~80min内,容器甲中v(NH3)=________________。
②反应Ⅰ的![]() ________0(填“>”或“<”),其原因为________________________。
________0(填“>”或“<”),其原因为________________________。
③关于容器乙,下列说法正确的是________(填选项字母)。
A.容器内![]() ,说明反应达到平衡状态
,说明反应达到平衡状态
B.反应进行到70min时,v正一定大于v逆
C.容器内气体平均相对分子质量在增大,说明平衡在正向移动
D.达平衡后,加入一定量NCl3(l),平衡逆向移动
E.达平衡后,按原投料比再充入一定量反应物,平衡后NH3的转化率增大
④温度为T1时HCl(g)的平衡体积分数=________,该温度下,若改为初始体积为2L的恒压容器,平衡时容器中n(Cl2)________(填“>”、“=”或“<”)1.6mol。
⑤温度为T2时,该反应的平衡常数K=________。
【答案】2△H-△H1 3.75×10-3molL-1min-1 < 容器乙反应速率快,所以T1>T2,又因为容器乙平衡时n(Cl2)大,说明温度升高,平衡逆向移动,△H2<0》 E 0.33或![]() < 0.6
< 0.6
【解析】
(1)根据盖斯定律进行计算;
(2)①由表中数据可知,0~80min内,容器甲中消耗氯气1.8mol,则由方程式可知消耗0.6mol氨气,结合![]() 计算;
计算;
②容器乙达到平衡用时少,则反应快,温度高,容器乙中平衡时n(Cl2)较大,说明升高温度平衡逆向移动,则正反应为放热反应;
④温度为T1时,达到平衡消耗2.4mol氯气,结合方程式计算;该温度下,若改为初始体积为2L的可变容器,则压强大于恒容时;
⑤计算平衡时各物质的浓度,可计算平衡常数。
(1)已知Ⅰ.![]()
![]() ;
;
Ⅱ.![]()
![]() ;根据盖斯定律2×Ⅰ-Ⅱ可得
;根据盖斯定律2×Ⅰ-Ⅱ可得![]() ,所以
,所以![]() =2△H-△H1,
=2△H-△H1,
故答案为:2△H-△H1
(2))①由表中数据可知,0~80min内,容器甲中消耗氯气1.8mol,则由方程式可知消耗0.6mol氨气,则![]() =3.75×10-3molL-1min-1
=3.75×10-3molL-1min-1
故答案为:3.75×10-3molL-1min-1;
②容器乙达到平衡用时少,则反应快,温度高,容器乙中平衡时n(Cl2)较大,说明升高温度平衡逆向移动,则正反应为放热反应,
故答案为:<;容器乙反应速率快,所以T1>T2,又因为容器乙平衡时n(Cl2)大,说明温度升高,平衡逆向移动,△H2<0;
③A.按1:1投入反应物,按1:3反应,无论任何时候,都不能满足![]() ,故A错误;
,故A错误;
B.根据图表可知达到平衡的时间在40到80min之间,无法确定反应进行到70min时是否达到平衡,故v正不一定大于v逆,故B错误;
C.由极限法考虑可知当4molNH3和4molCl2完全反应时容器内的平均相对分子质量减小,所以容器内气体平均相对分子质量在增大,说明平衡在逆向移动,故C错误
D.加入液体,平衡不移动,故错误;
E.达平衡后,按原投料比再充入一定量反应物,相当于增大压强,平衡正向移动,则平衡后NH3的转化率增大,故D正确;
故答案为:E;
④温度为T1时,

则HCl的体积分数为2.4/(3.2+1.6+2.4)=1/3,反应向体积减少的方向进行,如在恒容条件下,则压强减小,该温度下,若改为初始体积为2L的可变容器,则压强大于恒容时,平衡时容器中n(Cl2)<1.6mol,
故答案为:0.33或![]() ;<;
;<;
⑤温度为T2时
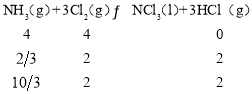
体积为2L,则K=![]() =0.6,
=0.6,
故答案为:0.6;

 科学实验活动册系列答案
科学实验活动册系列答案【题目】某实验室废液含![]() 、Na+、Fe3+、Cr3+、
、Na+、Fe3+、Cr3+、![]() 、
、![]() 等离子,现通过如下流程变废为宝制备K2Cr2O7。
等离子,现通过如下流程变废为宝制备K2Cr2O7。

已知:
(a)![]() ;
;![]()
(b)金属离子形成氢氧化物沉淀的pH范围如表。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 2.7 | 3.7 |
Cr3+ | 4.9 | 6.8 |
请回答:
(1)某同学采用纸层析法判断步骤①加入KOH的量是否合适。在加入一定量KOH溶液后,用毛细管取样、点样、薄层色谱展开、氨熏后的斑点如图所示。加入KOH最适合的实验编号是(实验顺序已打乱)________,C的斑点颜色为________。
(2)步骤②含Cr物质发生的主要反应的离子方程式为________________________。
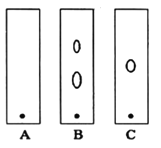
(3)在下列装置中,②应选用________。(填标号)
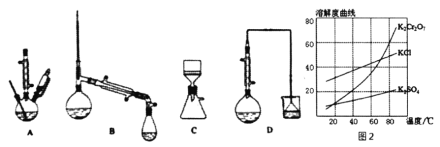
(4)部分物质的溶解度曲线如图2,步骤⑤可能用到下列部分操作:a.蒸发至出现大量晶体,停止加热;b.冷却至室温;c,蒸发至溶液出现晶膜,停止加热;d.洗涤;e.趁热过滤;f.抽滤。请选择合适操作的正确顺序________。
(5)步骤⑤中合适的洗涤剂是________(“无水乙醇”、“乙醇-水混合液”、“热水”、“冰水”)。
(6)取mg粗产品配成250mL溶液,取25.00mL于锥形瓶中,用cmol·L-1的(NH4)2Fe(SO4)2标准溶液滴定(杂质不反应),消耗标准(NH4)2Fe(SO4)2溶液VmL,则该粗产品中K2Cr2O7的纯度为________。
【题目】现有7瓶失去标签的试剂瓶,已知它们盛装的液体可能是乙醇、乙酸、苯、乙酸乙酯、油脂、葡萄糖溶液、蔗糖溶液。现通过如下实验来确定各试剂中所装液体的名称。
实验步骤和方法 | 实验现象 |
①把7瓶液体依次标号为A、B、C、D、E、F、G后闻气味 | 只有F、G两种液体没有气味 |
②各取少量于试管中加水稀释 | 只有C、D、E三种液体不溶解而浮在水上层 |
③分别取少量7种液体于试管中加新制的 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
④各取C、D、E少量于试管中,加稀 | 只有C中仍有分层现象,且在D的试管中闻到特殊香味 |
(1)试写出下列序号代表的液体名称:
A________,B________,C_______,D_______,E______,F______,G________。
(2)写出在D中加入![]() 溶液并加热的化学方程式:_______。
溶液并加热的化学方程式:_______。