题目内容
【题目】图中A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下气态化合物,C为常温下液态化合物,图中有部分生成物未标出.请填写以下空白: 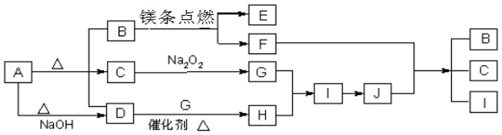
(1)A的化学式 , D的结构式 .
(2)写出下列反应的化学方程式:F+J→B+C+I;
(3)容积为10mL的试管中充满I和G的混合气体,倒立于盛水的水槽中,水全部充满试管,则原混合气体中I的体积为 , 若试管中的溶质不扩散,则试管中溶液的物质的量浓度为 . (该条件下的气体摩尔体积为22.4L/mol,结果保留两位有效数字.)
【答案】
(1)NH4HCO3;![]()
(2)C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(3)8mL;0.036mol/L
【解析】解:A受热能分解,分解得到等物质的量的B、C、D,且A与碱反应生成气体D,B、D为常温下气态化合物,C为常温下液态化合物,C为水,则A为NH4HCO3 , B能与镁反应,则B为CO2 , E为MgO,F为C,结合D为NH3 , 水与过氧化钠反应生成G,G为O2 , D与G反应生成H,H为NO,I为NO2 , J为HNO3 , 再结合F与J反应生成B、C、I,符合上述转化,(1)由上述分析可知A为NH4HCO3 , D为NH3 , 氨气分子中含有3个N﹣H键,其结构式为: ![]() ,所以答案是:NH4HCO3;
,所以答案是:NH4HCO3; ![]() ;(2)F+J→B+C+I的反应为为碳与浓硝酸生成二氧化碳、二氧化氮和水,反应方程式为:C+4HNO3(浓)
;(2)F+J→B+C+I的反应为为碳与浓硝酸生成二氧化碳、二氧化氮和水,反应方程式为:C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O,所以答案是:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,所以答案是:C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O;(3)由4NO2+O2+2H2O═4HNO3 , 倒立于盛水的水槽中,水全部充满试管,则原混合气体中NO2占
CO2↑+4NO2↑+2H2O;(3)由4NO2+O2+2H2O═4HNO3 , 倒立于盛水的水槽中,水全部充满试管,则原混合气体中NO2占 ![]() ,其体积为:10mL×
,其体积为:10mL× ![]() =8mL,生成硝酸的物质的量等于二氧化氮物质的量,n(NO2 )=
=8mL,生成硝酸的物质的量等于二氧化氮物质的量,n(NO2 )= ![]() =
= ![]() ×10﹣3mol,则反应后硝酸的物质的量为:n(HNO3)=n(NO2 )=
×10﹣3mol,则反应后硝酸的物质的量为:n(HNO3)=n(NO2 )= ![]() ×10﹣3mol,所得溶液浓度为:c(HNO3)=
×10﹣3mol,所得溶液浓度为:c(HNO3)= ![]() ≈0.036molL﹣1 , 所以答案是:8mL;0.036 mol/L.
≈0.036molL﹣1 , 所以答案是:8mL;0.036 mol/L.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案