题目内容
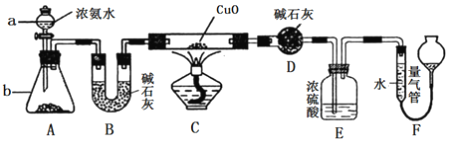
【题目】为探究NH3的溶解性,某兴趣小组按如图所示装置进行实验(f为止水夹),请回答下列问题: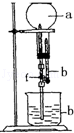
(1)写出实验室制取氨气的化学方程式 .
(2)要得到干燥的氨气可选用 作干燥剂.
A.碱石灰(CaO和NaOH的混合物)
B.浓硫酸
C.浓硝酸
D.氢氧化钠溶液
(3)用如图装置进行喷泉实验,烧瓶中已装满干燥氨气,引发水上喷的操作是 .
【答案】
(1)2NH4Cl+Ca(OH)2 ![]() 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
(2)A
(3)打开止水夹f,挤出胶头滴管中的液体,并轻轻摇动烧瓶,打开止水夹
【解析】解:(1)在加热条件下,氯化铵和氢氧化钙反应生成氯化钙、水和氨气,反应方程式:2NH4Cl+Ca(OH)2 ![]() 2NH3↑+CaCl2+2H2O,故答案为:2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O,故答案为:2NH4Cl+Ca(OH)2 ![]() 2NH3↑+CaCl2+2H2O;(2)浓硫酸和浓硝酸具有酸性,氨气是碱性气体,所以,浓硫酸和浓硝酸都不能干燥氨气,氢氧化钠溶液不能干燥气体,故答案为:A;(3)氨气是一种极易溶于水的气体,将胶头滴管中的水挤入烧瓶中,瓶内压强减小,在外界气压的作用下,水被压到瓶内,形成喷泉现象,故答案为:打开止水夹f,挤出胶头滴管中的液体,并轻轻摇动烧瓶,打开止水夹.
2NH3↑+CaCl2+2H2O;(2)浓硫酸和浓硝酸具有酸性,氨气是碱性气体,所以,浓硫酸和浓硝酸都不能干燥氨气,氢氧化钠溶液不能干燥气体,故答案为:A;(3)氨气是一种极易溶于水的气体,将胶头滴管中的水挤入烧瓶中,瓶内压强减小,在外界气压的作用下,水被压到瓶内,形成喷泉现象,故答案为:打开止水夹f,挤出胶头滴管中的液体,并轻轻摇动烧瓶,打开止水夹.
(1)实验室用氯化铵和氢氧化钙加热制取氨气;(2)干燥气体时必须满足气体不能与干燥剂反应;(3)喷泉实验利用的原理是压强差,氨气极易溶于水.

 口算题天天练系列答案
口算题天天练系列答案【题目】某同学在用稀硫酸与过量的锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是___________________;并用简单的装置图来表明你所阐述的理由______________________________;
(2)要加快上述实验中气体产生的速率,还可采取的措施有_______________;
(3)下列物质的加入能减慢氢气生成速率但不影响生成氢气的体积的是_____
A.加入碳酸钠溶液 B.加入硫酸钠溶液
C.加入硝酸钠溶液 D.加入醋酸钠溶液
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到 6 个盛有过量 Zn 粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
混合溶液实验 | 1 | 2 | 3 | 4 | 5 | 6 |
4mol·mol-1H2SO4/mL | 40 | V1 | V2 | V3 | V4 | V5 |
饱和 CuSO4 溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V6、V8 分别是_____________;
②该同学最后得出的结论为:当加入少量 CuSO4 溶液时,生成氢气的速率会大大提高,随着加入的 CuSO4 溶液增多时,生成氢气的速率会______(填加快、减慢或不变)。理由___________________。