��Ŀ����
����Ŀ����ͼ��ij��ѧ��ȤС��̽����ͬ�����»�ѧ��ת��Ϊ���ܵ�װ�ã���ش��������⣺ 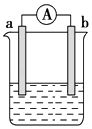
��1�����缫aΪAl���缫bΪCu���������ҺΪŨ����ʱ�������ĵ缫��ӦʽΪ�� ��
��2�����缫aΪAl���缫bΪMg���������ҺΪ����������Һʱ���õ�ص�����Ϊ �� �����ĵ缫��ӦʽΪ�� �� ����Ӧ���ռ�����״����448mL����ʱ�����ĵĵ缫����Ϊg��
��3��ȼ�ϵ�صĹ���ԭ���ǽ�ȼ�Ϻ�����������O2����Ӧ������������ֱ��ת��Ϊ���ܣ������һȼ�ϵ�أ��Ե缫aΪ�������缫bΪ�������Ҵ���C2H5OH��Ϊȼ�ϣ���������������ҺΪ���Һ�����Ҵ�Ӧͨ�������a����b�������õ缫�ĵ缫��ӦʽΪ�� ��
���𰸡�
��1��2H++NO3��+e���TNO2��+H2O
��2��Mg��Al+4OH����3e���TAlO2��+2H2O��0.36
��3��b��C2H5OH+16OH����12e���T2CO32��+11H2O
���������⣺��1��Al��Ũ�����жۻ�����������������ϵõ��ӱ���ԭΪ�����������缫��ӦʽΪ2H++NO3��+e���TNO2��+H2O�� ���Դ��ǣ�2H++NO3��+e���TNO2��+H2O����2��Al����NaOH��Һ����������ԭ��Ӧ�����ӷ�ӦΪ2Al+2OH��+2H2O=2AlO2��+3H2������AlΪ������MgΪ������������Alʧȥ���ӣ��缫��ӦΪAl+4OH����3e���TAlO2��+2H2O������Ӧ���ռ�����״����448mL��0.02mol����ʱ��
2Al+2OH��+2H2O=2AlO2��+ | 3H2�� |
54g | 3mol |
m��Al�� | 0.02mol |
�����ĵĵ缫Al������Ϊ��m��Al��= ![]() ��54g=0.36g��
��54g=0.36g��
���Դ��ǣ�Mg��Al+4OH����3 e���TAlO2��+2H2O��0.36����3���Ҵ�ȼ�ϵ���У�ͨ��ȼ�ϵĵ缫�Ǹ��������Ҵ�Ӧͨ��b�����ڼ��Ի������Ҵ�ʧ���Ӳ���̼�����ˮ���缫��ӦʽΪC2H5OH+16OH����12e���T2CO32��+11H2O��
���Դ��ǣ�b��C2H5OH+16OH����12e���T2CO32��+11H2O��

 �����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�