题目内容
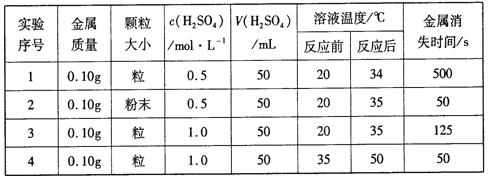
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
(1)25℃时,将pH=12的NaOH溶液100mL,要使溶液pH降为11,需加入水的体积为:
(2)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a与b应满足的关系是 .
【答案】
(1)900mL
(2)a+b=14或pH1+pH2=14
【解析】解:曲线A条件下Kw=c(H+)×c(OH﹣)=10﹣7×10﹣7=10﹣14,曲线B条件下c(H+)=c(OH﹣)=10﹣6 mol/L,Kw=c(H+)c(OH﹣)=10﹣12,水的电离时吸热过程,加热促进电离,所以A代表25℃时水的电离平衡曲线,B为95℃时水的电离曲线,(1)25℃时pH=12NaOH溶液中氢氧根离子的浓度为0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度为0.001mol/L,
稀释过程中氢氧根离子的物质的量基本不变,设需要加入水的体积为x,
则: ![]() =0.001mol/L,解得:x=0.9L=900mL,
=0.001mol/L,解得:x=0.9L=900mL,
所以答案是:900mL;(2)要注意的是95°C时,水的离子积为10﹣12,即酸、碱浓度相等时pH(酸)+pH(碱)=12,现强碱的OH﹣浓度是强酸H+浓度的100倍,所以pH(酸)+pH(碱)=14,即a+b=14或pH1+pH2=14,
所以答案是:a+b=14 或pH1+pH2=14.

练习册系列答案
相关题目