题目内容
(6分)按要求回答下列问题
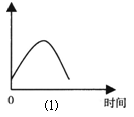
(1)把锌片投入到盛有盐酸的敞口容器中,产生H2的速率可由图⑴表示。
在下列因素中对产生H2速率有影响的是
①盐酸的浓度 ②锌片的表面积 ③溶液的温度 ④Cl-的浓度
(2)若向等量的两份稀硫酸a和b中, 分别加入过量的锌粉, 并向a中加入少量铜粉, 下图表示产生H2的体积(V)与时间(t)的关系正确的是 ,若向a中加入少量CH3COONa固体,图像正确的是
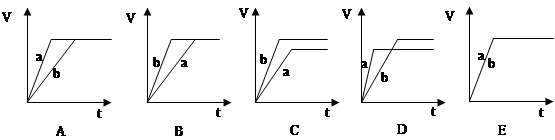
(1)把锌片投入到盛有盐酸的敞口容器中,产生H2的速率可由图⑴表示。
在下列因素中对产生H2速率有影响的是

①盐酸的浓度 ②锌片的表面积 ③溶液的温度 ④Cl-的浓度
| A.①④ | B.③④ | C.①②③ | D.②③ |
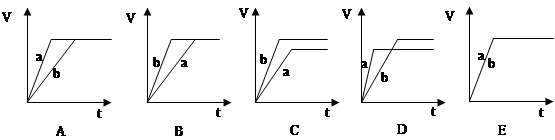
(1) C (2) A , B
试题分析:(1)Zn与HCl反应的实质是Zn+2H+=Zn2++H2↑。①盐酸的浓度越大化学反应速率越快。正确。 ②锌片的表面积越大,反应速率越快,正确;③溶液的温度越高,化学反应速率越快;④由反应的蜡烛方程式可知:Cl-的浓度与化学反应速率无关。因此对产生H2速率有影响的是①②③。选项为C。(2)a中加入了少量铜粉,这样就构成了Zn、Cu原电池。加快了化学反应速率。因此a比b快,由于放出氢气的多少按照硫酸来计算。两个容器中的硫酸相同没声音最终放出的氢气相同。故图像为A。若向a中加入少量CH3COONa固体,则由于会发生反应:2CH3COONa+ H2SO4= Na2SO4+2CH3COOH.由于消耗了H+,c(H+)降低,化学反应速率减慢。当c(H+)降低到一定程度,CH3COOH.就会与金属发生反应,最后放出的氢气的量不会改变,因此选项为B。

练习册系列答案
相关题目
 R(气)+2L此反应符合下面图象,下列叙述正确的是( )
R(气)+2L此反应符合下面图象,下列叙述正确的是( )