题目内容
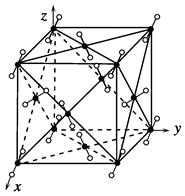
干冰晶体是一种面心立方结构,如图所示,即每8个CO2构成立方体,且在6个面的中心各有1个,在每个CO2周围距离为 a(其中a为立方体棱长)的CO2有( )。
a(其中a为立方体棱长)的CO2有( )。
 a(其中a为立方体棱长)的CO2有( )。
a(其中a为立方体棱长)的CO2有( )。
| A.4个 | B.8个 | C.12个 | D.6个 |
C
每个CO2周围距离为 a的CO2为12个。
a的CO2为12个。
 a的CO2为12个。
a的CO2为12个。
练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
题目内容
 a(其中a为立方体棱长)的CO2有( )。
a(其中a为立方体棱长)的CO2有( )。
| A.4个 | B.8个 | C.12个 | D.6个 |
 a的CO2为12个。
a的CO2为12个。
 孟建平名校考卷系列答案
孟建平名校考卷系列答案