题目内容
下列描述中正确的是( )
| A.CS2分子的立体结构为V形 |
| B.SiF4和SO32-的中心原子均为sp2杂化 |
| C.SF6中有6对完全相同的成键电子对 |
| D.ClO3-的空间构型为平面三角形 |
A.二硫化碳分子中碳原子含有2个σ键且不含孤电子对,所以其空间构型是直线型,故A错误;
B.SiF4中硅原子含有4个σ键且不含孤电子对,所以硅原子采用sp3杂化,SO32-中价层电子对个数=3+
(6+2-3×2)=4,所以硫原子为sp3杂化,故B错误;
C.SF6中价层电子对个数=6+
(6-6×1)=6,且不含孤电子对,所以有6对完全相同的成键电子对,故C正确;
D.ClO3-中价层电子对个数=3+
(7+1-3×2)=4,且含有一个孤电子对,所以其空间构型为三角锥型,故D错误;
故选:C.
B.SiF4中硅原子含有4个σ键且不含孤电子对,所以硅原子采用sp3杂化,SO32-中价层电子对个数=3+
| 1 |
| 2 |
C.SF6中价层电子对个数=6+
| 1 |
| 2 |
D.ClO3-中价层电子对个数=3+
| 1 |
| 2 |
故选:C.

练习册系列答案
相关题目
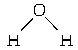
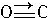 ,与CO结构最相似的分子是______(填写化学式),这两种结构相似的分子中,分子的极性______(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个不同,它叫______键.
,与CO结构最相似的分子是______(填写化学式),这两种结构相似的分子中,分子的极性______(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个不同,它叫______键.
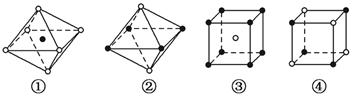
 a(其中a为立方体棱长)的CO2有( )。
a(其中a为立方体棱长)的CO2有( )。