��Ŀ����
����Ŀ����������(CH3COOOH)����ɫ��Һ��,������ˮ���ӷ�,�����ֽ�,����ǿ�����Եĸ�Ч������,ʹ�ù�������������ʱͨ������ˮϡ��ҵƷ��������,Ȼ�����������Կ���������������.
(1)����220mL0.05mol/L�Ĺ���������Һ,��ʹ�õ������У��ձ�����Ͳ����������__________________��____________________��
(2)���ƹ�����,��������Ũ��ƫ�ߵIJ�����__________________
A.����ƿ������ˮϴ�Ӻ�δ����,������������ˮ
B.ת����Һʱ,������������Һ��������ƿ��
C.����ʱ,��������ƿ�̶��߽��ж���
D.���ݺ�,������ƿ����ҡ�Ⱥ���Һ����ڿ̶���,���伸��ˮ���̶���
(3)���������Сʱ�ڻ���ȫ�ֽ������(CH3COOH)��һ�ֳ��������嵥��,��������嵥�ʵ�ʵ�鷽����_____________________________.
(4)����������������ԭ��CH3COONa�л�����SO42��,Ҫ�����SO42����ѡ�������Լ����ռ����Ⱥ�˳�����__________________________________________(�Լ�����ѡ��,����ż���)
������ڴ��ᱵ��Һ�����Ȼ�����Һ���ܴ����̼������Һ����NaHCO3��Һ.
(5)��ȡ�������ᷴӦԭ��Ϊ��H2O2��CH3COOH![]() CH3COOOH(��������)��H2O,�ֳ�ȡ5.0g������������ȡ�Ĺ�����������(Һ��),ϡ����100mL����.ȡ����ϡ�ͺ������������5.0mL,��0.01mol/L KMnO4��Һ�Գ�ȥ���е�H2O2,�漴����10% KI��Һ10 mL,ҡ��(��ѧ��Ӧ����ʽΪCH3COOOH��2KI��CH3COOK��I2��KOH)�ٽ�0.05mol/L Na2S2O3����Һ���뵽���������Һ��(��ѧ��Ӧ����ʽΪ��I2��2Na2S2O3��2NaI��Na2S4O6),����Na2S2O3����Һ�������Ϊ20mL.ͨ������ȷ��ԭ�����й����������������Ϊ____________________.
CH3COOOH(��������)��H2O,�ֳ�ȡ5.0g������������ȡ�Ĺ�����������(Һ��),ϡ����100mL����.ȡ����ϡ�ͺ������������5.0mL,��0.01mol/L KMnO4��Һ�Գ�ȥ���е�H2O2,�漴����10% KI��Һ10 mL,ҡ��(��ѧ��Ӧ����ʽΪCH3COOOH��2KI��CH3COOK��I2��KOH)�ٽ�0.05mol/L Na2S2O3����Һ���뵽���������Һ��(��ѧ��Ӧ����ʽΪ��I2��2Na2S2O3��2NaI��Na2S4O6),����Na2S2O3����Һ�������Ϊ20mL.ͨ������ȷ��ԭ�����й����������������Ϊ____________________.
���𰸡�250mL����ƿ ��ͷ�ι� C �ô����ǵ�ľ���Ӵ�����,�۲��Ƿ�ȼ �ڢݢ� 15.2%
��������
(1)�������Ʋ����Ǽ��㡢��ȡ��ϡ�͡���ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȡ�װƿ��������Ҫ��������
(2)����c=![]() ��������ʵ����ʵ���n����Һ�����V�ı仯��������������
��������ʵ����ʵ���n����Һ�����V�ı仯��������������
(3) ���������ֽܷ�Ϊ���������������������ʹ�����ǵ�ľ����ȼ��������
(4)��ȥCH3COONa�л�����SO42����Ӧ��������Ĵ��ᱵ��Ȼ���̼���Ƴ�ȥ�����ı����������Ӵ����ȥ������̼���������
(5)����CH3COOOH��2KI��CH3COOK��I2��KOH��I2��2Na2S2O3��2NaI��Na2S4O6������ѧ����ʽ�����Եù�ϵʽ���£�CH3COOOH��I2��2 Na2S2O3���ݴ˼���ϡ�ͺ�5mL��Ӧ��n��CH3COOOH������������ԭ�����й������������������
(1)�������Ʋ����Ǽ��㡢��ȡ��ϡ�͡���ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȡ�װƿ����֪���������������Ͳ���ձ�����������250mL����ƿ�ͽ�ͷ�ι����ʳ����ձ�����Ͳ����������������Ҫ250mL����ƿ����ͷ�ι���
��ˣ�������ȷ������250mL����ƿ����ͷ�ι���
(2)A.����ƿ������ˮϴ�Ӻ�δ������������������ˮ��������Һ��Ũ����Ӱ������A������
B.ת����Һʱ��������������Һ��������ƿ������������ʵ���ʧ����Ũ��ƫ������B������
C.����ʱ����������ƿ�̶��߽��ж���������Һ���ƫС��Ũ��ƫ��������Cѡ������ȷ����
D.���ݺ���������ƿ����ҡ�Ⱥ���Һ����ڿ̶����������������ز��伸��ˮ���̶�����������������Ũ��ƫ������D������
��ˣ�������ȷ������C��
(3) ���������ֽܷ�Ϊ�������������������ʹ�����ǵ�ľ����ȼ���ʼ��������ķ���Ϊ�ô����ǵ�ľ���Ӵ����壬�۲��Ƿ�ȼ��
��ˣ�������ȷ���ǣ��ô����ǵ�ľ���Ӵ����壬�۲��Ƿ�ȼ��
(4)��ȥCH3COONa�л�����SO42����Ӧ���뱵�������뱵���������Ӳ�Ҫ���������ʵĽǶ���������Ӧ��������Ĵ��ᱵ��Ȼ��ӹ�����̼���Ƴ�ȥ�����ı����������Ӵ����ȥ������̼���������
��ˣ�������ȷ�������ڢݢܣ�
(5)����CH3COOOH��2KI��CH3COOK��I2��KOH��I2��2Na2S2O3��2NaI��Na2S4O6������ѧ����ʽ�����Եù�ϵʽ���£�CH3COOOH��I2��2 Na2S2O3���ɹ�ϵʽ��֪��n��CH3COOOH��=![]() n��Na2S2O3��=
n��Na2S2O3��=![]() ��0.05mol/L��0.02L=5��10-4mol��
��0.05mol/L��0.02L=5��10-4mol��
��ԭ��Ʒ��w��CH3COOOH��=![]() 100%=15.2%��
100%=15.2%��
��ˣ�������ȷ������15.2%��

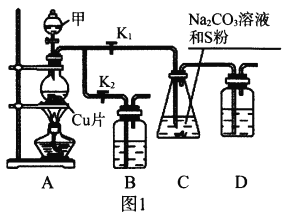
 ����С״Ԫ��������������ϵ�д�
����С״Ԫ��������������ϵ�д�����Ŀ������ͼ��ʾװ�ú���Ӧ�Լ��ܴﵽʵ��Ŀ�ĵ����� ��
ѡ�� | ʵ��Ŀ�� | �Լ�a | �Լ�b | �Լ�c | װ�� |
A | ��֤�ǽ�����:S>C>Si | ϡ���� | Na2CO3 | Na2SiO3��Һ |
|
B | �Ʊ�������NO | Ũ���� | Cu | ˮ | |
C | ������ҺX�к���CO32- | ���� | ��ҺX | ����ʯ��ˮ | |
D | ��ȥNa2SO3�е�Na2SO4 | ��ˮ | ����� | NaOH��Һ |
A. A B. B C. C D. D