题目内容
【题目】用如图所示装置和相应试剂能达到实验目的的是( )
选项 | 实验目的 | 试剂a | 试剂b | 试剂c | 装置 |
A | 验证非金属性:S>C>Si | 稀硫酸 | Na2CO3 | Na2SiO3溶液 |
|
B | 制备纯净的NO | 浓硝酸 | Cu | 水 | |
C | 检验溶液X中含有CO32- | 盐酸 | 溶液X | 澄清石灰水 | |
D | 除去Na2SO3中的Na2SO4 | 氯水 | 混合物 | NaOH溶液 |
A. A B. B C. C D. D
【答案】A
【解析】
A.非金属元素最高价氧化物是水化物酸性越强,其非金属性越强,根据强酸制取弱酸判断;B.根据NO的性质和Cu与浓硝酸反应的产物判断;C.能够使澄清石灰水变浑浊的气体可能为二氧化碳或二氧化硫,溶液X中可能为碳酸氢根离子或亚硫酸根离子;D.除杂试剂选用氯水,引进了杂质氯离子,且将亚硫酸钠氧化成硫酸钠,违反了除杂原则。
硫酸能和碳酸钠反应制得二氧化碳,二氧化碳和硅酸钠溶液反应生成不溶性的硅酸,所以该实验证明酸性H2SO4>H2CO3>H2SiO3,则非金属性S>C>Si,A选项正确;Cu与浓硝酸反应生成NO2,不生成NO,NO遇空气中的氧气立即生成NO2,装置广口瓶上部有空气,也得不得纯净的NO气体,B选项错误;二氧化硫和二氧化碳都能够时澄清石灰水变浑浊,无法检验溶液X中是否含有CO32-,C选项错误;除杂试剂选用氯水,氯水Na2SO3氧化成Na2SO4,反应后引进了杂质氯离子,违反了除杂原则,无法达到实验目的,D选项错误;正确选项A。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】甲醇是一种重要化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为__________________。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl | SO42- |
c/mol·L-1 | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为____。
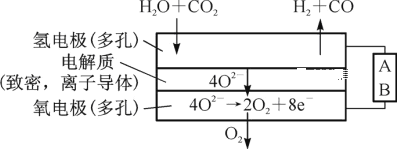
(2)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1 000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2—,O2—穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由图可知A为直流电源的____(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:________。