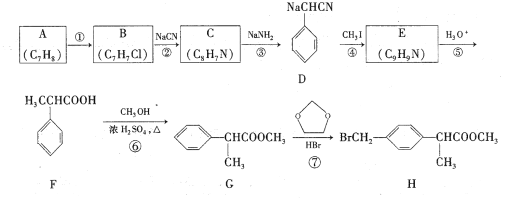
题目内容
【题目】铁红(Fe2O3)和钛白粉(TiO2)均为重要的墙面装修颜料。一种利用钛铁矿(主要成分为FeTiO3,还含有少量Fe2O3)联合生产铁红和钛白粉的工艺流程如图所示:
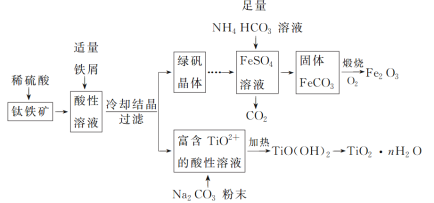
回答下列问题:
(1)FeTiO3中Fe的化合价为_______。
(2)为加快钛铁矿在稀硫酸中的溶解,可采取的措施有_______ (任写两种)。酸性溶液中加入适量铁屑的目的是将_______。
(3)FeSO4溶液与NH4HCO3溶液的反应温度应控制在35 ℃以下,其原因是_______,该反应的离子方程式是Fe2++2HCO3-=FeCO3↓+CO2↑+H2O。
(4)TiO2+转化为TiO(OH)2需要加热,加热的目的是_______,该反应的离子方程式为TiO2++2H2O![]() TiO(OH)2↓+2H+。
TiO(OH)2↓+2H+。
(5)常温时,在生成的FeCO3达到沉淀溶解平衡的溶液中,测得溶液中c(CO32-)=3.0×10-6 mol·L-1,pH为8.5,则所得的FeCO3中是否含Fe(OH)2_______?
【答案】+2 采用钛铁矿粉末、升高温度、使用浓度较大的稀硫酸等(任写两种) Fe3+还原为Fe2+ 减少NH4HCO3分解、减少Fe2+水解 促进水解,加快反应速率 无
【解析】
钛铁矿[主要成分为钛酸亚铁(FeTiO3),含有少量Fe2O3]加硫酸溶解生成TiO2+和Fe3+、Fe2+,加入铁还原铁离子:2Fe3++Fe=3Fe2+,得到硫酸亚铁和TiOSO4,对溶液蒸发浓缩、冷却结晶,过滤得到绿矾晶体和TiOSO4溶液,将TiOSO4溶液加热,促进TiO2+的水解生成TiO(OH)2,TiO2++2H2O=TiO(OH)2+2H+,分解得到TiO2nH2O;绿矾晶体溶于水,加入足量碳酸氢铵溶液可生成碳酸亚铁和二氧化碳,通入氧气煅烧可生成氧化铁,以此解答该题。
(1)由化合物中各元素的化合价代数和为0可知FeTiO3中Fe的化合价为+2;
(2)增大反应物接触面积、提高反应温度或提高反应物浓度均能加快反应速率。Fe具有还原性,可将Fe3+还原为Fe2+;
(3)温度太高,则NH4HCO3易分解,且降低温度可减少Fe2+的水解;
(4)TiO2+水解生成TiO(OH)2,加热可以加快水解反应速率;
(5) Ksp(FeCO3)=c(Fe2+)·c(CO32-),故c(Fe2+)=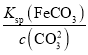 =1.0×10-5mol·L-1,pH=8.5,则c(OH-)=10-5.5mol·L-1,故c(Fe2+)·c2(OH-)=10-16<Ksp[Fe(OH)2]=8.0×10-16,故所得的FeCO3中无Fe(OH)2。
=1.0×10-5mol·L-1,pH=8.5,则c(OH-)=10-5.5mol·L-1,故c(Fe2+)·c2(OH-)=10-16<Ksp[Fe(OH)2]=8.0×10-16,故所得的FeCO3中无Fe(OH)2。