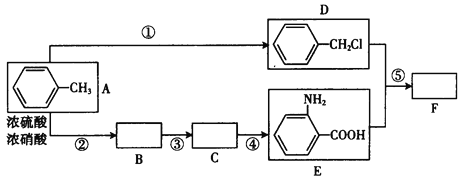
题目内容
【题目】实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行反应热测定。

(1)写出该反应的热化学方程式[生成1mol H2O(l)时的反应热为-57.3 kJ·mol-1]________________________。
(2)取50mLNaOH溶液和30 mL硫酸溶液进行实验。
①实验数据如下表,温度差平均值为_________
温度 次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1.0 g·mL-1,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则生成1 mol H2O(l)时的反应热ΔH=_____(列出计算式即可,单位为kJ·mol-1)。
③上述实验数值结果大于-57.3 kJ·mol-1,产生偏差的原因不可能是_____
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【答案】H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1 4.0℃ ![]() b
b
【解析】
(1)中和热为强酸和强碱的稀溶液发生中和反应生成1molH2O(l)时的焓变,为-57.3 kJ·mol-1,NaOH和硫酸反应的热化学方程式为:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l) ΔH=![]() ;答案为:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1;
;答案为:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1;
(2)①第2组数据偏差较大,不可靠,应舍去,其他三组的温度差平均值为![]() ,答案为:4.0℃;
,答案为:4.0℃;
②50mL0.50 mol·L-1NaOH溶液和30 mL 0.50 mol·L-1硫酸溶液进行中和反应生成水的物质的量为![]() ,混合溶液的质量为
,混合溶液的质量为![]() ,温度变化的值为ΔT=4.0℃,则生成0.025mol水放出的热量Q=
,温度变化的值为ΔT=4.0℃,则生成0.025mol水放出的热量Q=![]() ,即1.3376kJ,所以实验测得是中和热ΔH=
,即1.3376kJ,所以实验测得是中和热ΔH=![]() ;答案为:
;答案为:![]() ;
;
③a.实验装置保温、隔热效果必须好,否则导致测得的放热值偏小,得到的中和热数值偏小,a项正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的NaOH溶液体积偏大,放出的热量值偏高,则测得中和热的数值偏大,b项错误;
c.尽量一次快速地将NaOH溶液倒入盛有硫酸的小烧杯中,分多次把NaOH溶液倒入盛有硫酸的小烧杯中会导致热量散失,使得测量的温度差偏小。得到的中和热的数值偏小,c项正确;
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,酸碱中和放热,使得测得的硫酸的起始温度偏高,温度差偏小,得到的中和热的数值偏小,d项正确;
答案选b。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】下列实验结论与实验操作及现象不相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某酸雨样品中加入Ba(OH)2溶液,有白色沉淀生成 | 酸雨试样中一定含SO42- |
B | 向KI-淀粉溶液中滴入氯水,溶液变成蓝色 | I-的还原性强于Cl- |
C | 将Ba(OH)2·8H2O和NH4Cl晶体在小烧杯中混合搅拌,用手触摸烧杯外壁感觉变凉 | Ba(OH)2·8H2O与NH4Cl的反应是吸热反应 |
D | 向某盐溶液中加入NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口,试纸变蓝 | 该盐溶液中含有NH4+ |
A.AB.BC.CD.D
【题目】化学与人类生活密切相关。请按要求,回答下列问题:
(1)春秋末期工艺官书《考工记》中记载有“涑帛”的方法,即利用含有碳酸钠的水溶液来洗涤丝帛。请写出碳酸钠水溶液中通入CO2气体的化学方程式____,将54.8g Na2CO3和NaHCO3 的混合物分成等量的两份,一份溶于水后加入足量盐酸,收集到气体V L,另一份直接加热至恒重,生成气体2.24L(所有气体体积均在标准状况下测定),则原固体混合物中Na2CO3的物质的量:n(Na2CO3)=____,气体V=____。
(2)“84”消毒液在生活中使用广泛,其有效成分是次氯酸钠。可在常温下将氯气通入NaOH溶液制得,该反应的离子方程式为____,若有2mol氯气参与该反应,则此时转移的电子数为____NA。
(3)小苏打可用于治疗胃酸过多,其反应的离子方程式为____。
(4)长石是地表岩石最重要的造岩矿物。某种长石的化学组成KAlSi3O8则将其改写成氧化物的组合形式为____。
(5)葡萄糖(分子式C6H12O6)是人体活细胞的能量来源。已知1mol等于1000mmol,某体检单的一些指标如图,则每升该样品中含葡萄糖的质量为____g(请保留两位小数)。
9 | 白球比 | 1.6 | |
10 | 乳酸脱氢酶 | 161 | U/L |
11 | 磷酸肌酸激酶 | 56 | U/L |
12 | 甘油三酯 | 0.52 | mmol/L |
13 | 总胆固醇 | 4.27 | mmol/L |
14 | 高密度脂蛋白胆固醇 | 1.57 | mmol/L |
15 | 低密度脂蛋白胆固醇 | 1.40 | mmol/L |
16 | 葡萄糖 | 4.94 | mmol/L |