题目内容
14.NA为阿伏加德罗常数的数值,下列说法中正确的是( )| A. | 0.5molO3与11.2LO2所含的分子数一定相等 | |
| B. | 在密闭容器中加入1.5 mol H2和0.5 molN2,充分反应后可得到NH3分子数为NA | |
| C. | 常温常压下,7.0g乙烯与丁烯的混合物中含有氢原子的数目为NA | |
| D. | 标准状况下,22.4 L氯气与足量铁粉充分反应,转移的电子数为3 NA |
分析 A、氧气所处的状态不明确;
B、合成氨的反应为可逆反应;
C、乙烯和丁烯的最简式均为CH2;
D、求出氯气的物质的量,然后根据氯气反应后变为-1价来分析.
解答 解:A、氧气所处的状态不明确,故11.2L氧气的物质的量不能计算,故与0.5mol臭氧中的分子个数无法比较,故A错误;
B、合成氨的反应为可逆反应,故不能反应完全,则得到的分子个数小于NA个,故B错误;
C、乙烯和丁烯的最简式均为CH2,故7.0g混合物中含有的CH2的物质的量n=$\frac{7.0g}{14g/mol}$=0.5mol,则含有的氢原子的物质的量为1mol,个数为NA个,故C正确;
D、标况下22.4L氯气的物质的量为1mol,而氯气反应后变为-1价,故1mol氯气转移2mol电子即2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
5.证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是 ( )
| A. | 测定溶液的pH | B. | 加入Ba(OH)2溶液 | ||
| C. | 加入盐酸 | D. | 加入品红溶液 | ||
| E. | 用蓝色石蕊试纸检测 |
2.某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种. ①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法不正确的是( )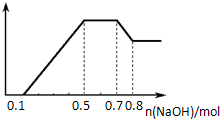

| A. | 溶液中的阳离子有H+、Mg2+、Al3+、NH4+ | |
| B. | 溶液中n(NH4+)=0.2 mol | |
| C. | 溶液中一定不含CO32-和NO3-,可能含有SO42- | |
| D. | n(H+):n(Al3+):n(Mg2+)=2:2:1 |
9.下列操作正确的是( )
| A. | 将金属钠保存在汽油中 | |
| B. | 将实验用剩下的钠,放回保存钠的试剂瓶中 | |
| C. | 用手掰开一块金属钠,观察钠的颜色 | |
| D. | 向盛水的烧杯中投入拇指大小的钠块,观察现象 |
6.下列不属于分离混合物的方法的是( )
| A. | 洗气 | B. | 过滤 | C. | 结晶 | D. | 振荡 |
3.下列各项中实验目的与实验操作和现象相符的是( )
| 选项 | 实验目的 | 实验操作和现象 |
| A | 检验含Fe2+、Fe3+混合溶液中的Fe2+ | 向溶液中加入足量新制氯水,再加入少量KSCN溶液,溶液变红 |
| B | 检验木炭与浓硫酸反应会生成CO2 | 浓硫酸和木炭混合加热,将生成的气体通入足量澄清石灰水,澄清石灰水变浑浊 |
| C | 验证非金属性:Si<C<Cl | 向Na2CO3固体中加入过量盐酸,将产生的气体直接通入NaSiO3中,产生白色沉淀 |
| D | 验证Ksp[Cu(OH)2]<Ksp[Mg (OH)2] | 向NaOH溶液中滴加足量的MgCl2溶液,产生白色沉淀,在滴加足量的CuCl2溶液,沉淀变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
12.将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)?2C(g),若经2s后测得C的浓度为0.6mol•L-1,现有下列几种说法正确的是( )
| A. | 2s末用物质A表示的反应速率为0.3mol/(L•s) | |
| B. | 2s内用物质B表示的反应速率为0.15mol/(L•s) | |
| C. | 2s时物质A的转化率为70% | |
| D. | 2s时物质B的浓度为1.4 mol•L-1 |
 .固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:
.固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为: