题目内容
9.下列操作正确的是( )| A. | 将金属钠保存在汽油中 | |
| B. | 将实验用剩下的钠,放回保存钠的试剂瓶中 | |
| C. | 用手掰开一块金属钠,观察钠的颜色 | |
| D. | 向盛水的烧杯中投入拇指大小的钠块,观察现象 |
分析 A.汽油易挥发,Na保存在煤油中;
B.钠为易燃品,为危险药品,且钠价格昂贵;
C.钠具有腐蚀性;
D.大块钠与水发生剧烈反应,发生爆炸.
解答 解:A.汽油易挥发,应该把Na保存在煤油中,故A错误;
B.钠与煤油不反应,且密度比煤油小,可保存在煤油中,因钠易燃烧而导致实验事故,使用剩下的金属钠仍放回原瓶,故B正确;
C.钠具有腐蚀性,不能用手钠取,应用镊子取,用小刀切割,故C错误;
D.大块钠与水发生剧烈反应,发生爆炸,为氨气起见,应取黄豆粒大小钠与水反应,故D错误;
故选:B.
点评 本题考查了元素化合物性质,涉及钠的存放、取用方法等,明确钠的性质是解题关键,题目难度不大.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
相关题目
19.工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)═CH3OH(g)△H<0,下列有关该反应的说法错误的是( )
| A. | 若容器中混合气体的平均相对分子质量不变,则该反应达到平衡状态 | |
| B. | 升高温度,平衡向逆反应方向移动 | |
| C. | 加入H2和使用催化剂均可提高CO的转化率 | |
| D. | 平衡时,分离出CH3OH,逆反应速率先减小,后逐渐增大,平衡正向移动 |
20.下列说法正确的是( )
| A. | 仅含有碳和氢两种元素的有机物称为烃 | |
| B. | 凡是分子里含碳元素的化合物都属于有机物 | |
| C. | 甲烷可以使酸性高锰酸钾溶液褪色 | |
| D. | 甲烷与氯气混合光照一段时间后黄绿色变浅,因为发生了置换反应 |
17.已知CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ.mol-1,现有0.75mol CH4和CO的混合气体,完全燃烧后生成CO2(g)和18g H2O(l),共放出515.9 kJ热量,由上可知1mol CO完全燃烧放出的热量为( )
| A. | 283kJ | B. | 374.4kJ | C. | 512kJ | D. | 566kJ |
4.下列溶液中Cl-的浓度与50mL 1mol/L的MgCl2溶液中的Cl-相等的是( )
| A. | 20mL0.5mol/L的CaCl2溶液 | B. | 50mL0.5 mol/L的AlCl3溶液 | ||
| C. | 100mL2mol/L的NaCl溶液 | D. | 1L0.2mol/L的KCl溶液 |
14.NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 0.5molO3与11.2LO2所含的分子数一定相等 | |
| B. | 在密闭容器中加入1.5 mol H2和0.5 molN2,充分反应后可得到NH3分子数为NA | |
| C. | 常温常压下,7.0g乙烯与丁烯的混合物中含有氢原子的数目为NA | |
| D. | 标准状况下,22.4 L氯气与足量铁粉充分反应,转移的电子数为3 NA |
7.乙苯催化脱氢制苯乙烯反应: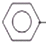 CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$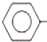 CH=CH2(g)+H2(g)
CH=CH2(g)+H2(g)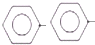
(1)已知
计算上述反应的△H=+124 kJ•mol-1.
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{n{α}^{2}}{(1-{α}^{2})V}$(用α等符号表示).
(3)工业上,通常在乙苯蒸汽中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
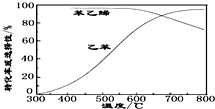
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺----乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利用CO2资源利用.
 CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH=CH2(g)+H2(g)
CH=CH2(g)+H2(g)
(1)已知
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{n{α}^{2}}{(1-{α}^{2})V}$(用α等符号表示).
(3)工业上,通常在乙苯蒸汽中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:

①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺----乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利用CO2资源利用.