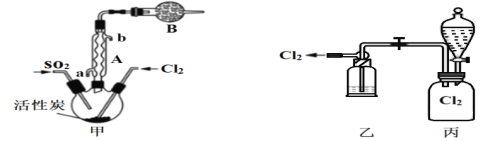
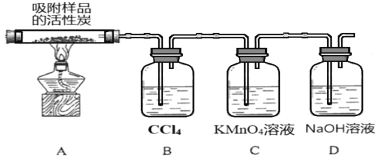
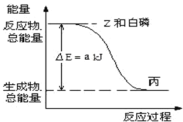
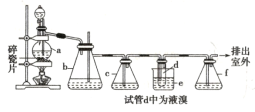
��Ŀ����
����Ŀ�������ܡ���Ϊ�������ڵ�����Ԫ�أ����ǵ����ʷdz����ƣ�Ҳ��Ϊ��ϵԪ�أ�
��1�������ܡ������Ǻܺõ���λ�������γ��壮
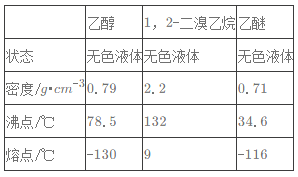
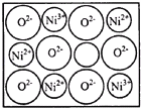
��[Co��H2O��6]2+�ڹ�����ˮ����ת��Ϊ[Co��NH3��6]2+��д��Co2+�ļ۲�����Ų�ͼ__��[Co��H2O��6]2+��Co2+����λ��Ϊ__��NH3���ӵ�����ԭ���ӻ���ʽΪ__��H2O���ӵ����幹��Ϊ__��
������������һ����̼�����γ��ʻ������磺Fe��CO��5��Ni��CO��4�ȣ�CO��N2���ڵȵ����壬��CO������������������Ŀ��Ϊ__��д����CO��Ϊ�ȵ������һ�������ӵ����ӷ���__��
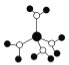
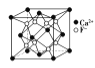
��2��+2�ۺ�+3����Fe��Co��Ni��Ԫ�س������ϼۣ�NiO��FeO�ľ���ṹ���;����Ȼ��Ƶ���ͬ��Ni2+��Fe2+�����Ӱ뾶�ֱ�Ϊ69pm��78pm�����۵�NiO__FeO��ѡ����������������=������ij����ȻNiO���������ͼ��ʾȱ�ݣ�һ��Ni2+��ȱ����������Ni2+������Ni3+��ȡ�������������Գʵ����ԣ�ij��������Ʒ���ΪNi0.97O���þ�����Ni3+��Ni2+��������֮��Ϊ__��
���𰸡�![]() 6 sp3 V�� 1��2 CN�� �� 6��91
6 sp3 V�� 1��2 CN�� �� 6��91
��������
���ݹ���ԭ������ԭ�Ӻ����ӵĺ�������Ų���������������Ľṹ�ص��������λ�������ݼ۲���ӶԻ������۷���ԭ�ӵ��ӻ���ʽ�����ӵĿռ乹�ͣ����ݵȵ���ԭ�������ȵ�����ijɼ��ص㣻�����Ȼ��ƾ���Ľṹ�ص�͵��������е�������֮�ȡ�
��1����Co��27��Ԫ�أ����ݹ���ԭ����֪�����̬ԭ�ӵļ۵����Ų�ʽΪ3d74s2����ʧȥ������2�����Ӻ��ΪCo2+����Co2+�ļ۲�����Ų�ͼΪ![]() ��
��
[Co��H2O��6]2+��6��ˮ���������壬��Co2+����λ��Ϊ6��
NH3���ӵ�����ԭ��Nԭ�ӵļ۵��Ӷ���Ϊ![]() 4�������ӻ���ʽΪsp3��
4�������ӻ���ʽΪsp3��
H2O���ӵ�Oԭ�ӵ��ӻ���ʽҲ��sp3������Oԭ�ӻ���2���µ��Ӷԣ���Գɼ����ӶԵij����ϴ�ˮ���ӵ����幹��ΪV�Σ�
��CO��N2���ڵȵ����壬���ڵ������ӵĽṹʽΪN��N����CO���ӵĽṹʽΪC��O��������������������Ŀ��Ϊ1��2�����ݵȵ�������γ�������֪����CO��Ϊ�ȵ��������������CN����
��2������NiO��FeO�ľ���ṹ���;����Ȼ��Ƶ���ͬ��Ni2+��Fe2+�����Ӱ뾶�ֱ�Ϊ69pm��78pm��Ni2+�İ뾶��С����NiO�ľ����ܽϴ��۵�NiO��FeO�� NiO���������ͼ��ʾȱ�ݣ������侧���Գʵ����ԣ����������ΪNi0.97O����Ni3+��Ni2+����Ŀ�ֱ�Ϊ����0.97-x��3x+2(0.97-x)=12����֮�ã�x=0.06����þ�����Ni3+��Ni2+��������֮��Ϊ0.06:0.91=6:91��

 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�