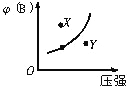
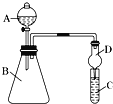
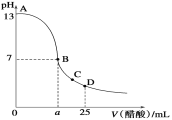
题目内容
【题目】A1-MnO4电池是一种高能电池,以Ga2O3为缓蚀剂,其示意图如图所示。已知电池总反应为Al + MnO4 ═AlO2- + MnO2.下列说法正确的是( )

A. 电池工作时,K+向负极移动
B. 电池工作时,电子由Al经电解质溶液流向Ni
C. 负极反应为Al- 3e + 4OH ═AlO2 + 2H2O
D. 电池工作时,Ni电极周围溶液pH减小
【答案】C
【解析】该电池的负极是Al,Ni是正极,在正极上发生得电子的还原反应,即MnO4-+2H2O+3e-═MnO2+4OH-,负极上金属铝失电子发生氧化反应,即Al- 3e + 4OH ═AlO2 + 2H2O,电池工作时,阳离子向正极移动,阴离子向负极移动,据此分析解答。
A.电池工作时,阳离子向正极移动,即K+向正极移动,故A错误; B.电池工作时,电子由负极流向正极,但是不会经过电解质溶液,故B错误;C.负极上金属铝失电子发生氧化反应,即Al- 3e + 4OH ═AlO2 + 2H2O,故C正确;D.电池工作时,负极上金属铝失电子发生氧化反应,即Al+4OH-═Al(OH)4-,Al电极周围溶液pH减小,故D错误;故选C。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④、⑤、⑥的离子半径由大到小的顺序为__________________。(用离子符号)
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_______________ 。(用化学式)
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______________。
(4)由表中①④两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________ _。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中①②两种元素可以组成多种烃,若原子也按1:1组成的常见液态化合物是重要的化工原料,也是常见的有机溶剂,写出该物质与硝酸发生反应的化学方程式: _______________。
(6)⑥的单质在⑤的最高价氧化物对应水化物中反应的离子方程式为:________________。