题目内容
(2010?江西模拟)恒温下,在容积为2L的密闭容器中发生3A(g)+2B(g)?2C(g)+xD (s)反应,若起始投料为3molA、2molB,2min达平衡,生成D1.2mol,测得从反应开始到平衡C的速率为0.3mol(L?min).下列结论不正确的是( )
分析:A、根据C的速率计算生成C的物质的量,再利用物质的量之比等于化学计量数之比计算x的值.
B、根据C的速率计算△c(C),利用浓度变化量之比等于化学计量数之比计算△c(A),A的平衡浓度=A起始浓度-△c(A).
C、根据C的速率计算平衡时C的物质的量,结合方程式利用差量法计算平衡时混合物总的物质的量,据此计算平衡时C的体积分数.
D、根据三段式计算平衡时n(A)=1.2mol,n(B)=0.8mol,n(C)=1.2mol,n(A):n(B):n(C):n(D)=3:2:3,按n(A):n(B):n(C):n(D)=3:2:3:3继续投料,等效为增大压强,平衡向体积减小方向移动.
B、根据C的速率计算△c(C),利用浓度变化量之比等于化学计量数之比计算△c(A),A的平衡浓度=A起始浓度-△c(A).
C、根据C的速率计算平衡时C的物质的量,结合方程式利用差量法计算平衡时混合物总的物质的量,据此计算平衡时C的体积分数.
D、根据三段式计算平衡时n(A)=1.2mol,n(B)=0.8mol,n(C)=1.2mol,n(A):n(B):n(C):n(D)=3:2:3,按n(A):n(B):n(C):n(D)=3:2:3:3继续投料,等效为增大压强,平衡向体积减小方向移动.
解答:解:A、平衡C的速率为0.3mol(L?min),则△n(C)=0.3mol(L?min)×2min×2L=1.2mol,物质的量之比等于化学计量数之比,所以2:x=1.2mol:1.2mol,解得x=2,故A正确;
B、平衡C的速率为0.3mol(L?min),所以△c(C)=0.3mol(L?min)×2min=0.6mol/L,利用浓度变化量之比等于化学计量数之比,所以△c(A)=
△c(C)=
×0.6mol/L=0.9mol/L,所以平衡时c(A)=
-0.9mol/L=0.6mol/L,故B正确;
C、平衡C的速率为0.3mol(L?min),则△n(C)=0.3mol(L?min)×2min×2L=1.2mol,
3A(g)+2B(g)?2C(g)+2D (s)物质的量减少△n
2 3
1.2mol 1.8mol
所以平衡时混合物的物质的量为3mol+2mol-1.8mol=3.2mol,所以C的体积分数为
=37.5%,故C正确;
D、对于反应 3A(g)+2B(g)?2C(g)+2D (s)
开始(mol):3 2 0
变化(mol):1.8 1.2 1.2
平衡(mol):1.2 0.8 1.2
平衡时n(A):n(B):n(C):n(D)=3:2:3,按n(A):n(B):n(C):n(D)=3:2:3:3继续投料,等效为增大压强,平衡向正反应方向移动,故D错误.
故选:D.
B、平衡C的速率为0.3mol(L?min),所以△c(C)=0.3mol(L?min)×2min=0.6mol/L,利用浓度变化量之比等于化学计量数之比,所以△c(A)=
| 3 |
| 2 |
| 3 |
| 2 |
| 3mol |
| 2L |
C、平衡C的速率为0.3mol(L?min),则△n(C)=0.3mol(L?min)×2min×2L=1.2mol,
3A(g)+2B(g)?2C(g)+2D (s)物质的量减少△n
2 3
1.2mol 1.8mol
所以平衡时混合物的物质的量为3mol+2mol-1.8mol=3.2mol,所以C的体积分数为
| 1.2mol |
| 3.2mol |
D、对于反应 3A(g)+2B(g)?2C(g)+2D (s)
开始(mol):3 2 0
变化(mol):1.8 1.2 1.2
平衡(mol):1.2 0.8 1.2
平衡时n(A):n(B):n(C):n(D)=3:2:3,按n(A):n(B):n(C):n(D)=3:2:3:3继续投料,等效为增大压强,平衡向正反应方向移动,故D错误.
故选:D.
点评:考查化学平衡计算、化学反应速率计算,难度中等,注意D选项三段式有关计算与等效思想运用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
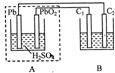 (2010?江西模拟)该图装置中,A为铅蓄电池,C1、C2为石墨电极,B烧杯中是浓度均为0.1mol/L的H2SO3和KI的混合溶液100mL.下列说法正确的是( )
(2010?江西模拟)该图装置中,A为铅蓄电池,C1、C2为石墨电极,B烧杯中是浓度均为0.1mol/L的H2SO3和KI的混合溶液100mL.下列说法正确的是( )