题目内容
(2010?江西模拟)一定条件下,氮氧化物 (NOx)形成的污染可以用甲烷来消除.已知:①CH4(g)+4NO2(g)-4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol②CH4(g)+4NO(g)-2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol下列选项正确的是( )
分析:A、根据x=1.6计算二氧化氮和一氧化氮物质的量之比,结合①②计算分析判断;
B、利用盖斯定律计算CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)的反应热,根据水的状态不同,放出的热量不同判断;
C、根据CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)的反应热计算;
D、根据化合价的变化计算.
B、利用盖斯定律计算CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)的反应热,根据水的状态不同,放出的热量不同判断;
C、根据CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)的反应热计算;
D、根据化合价的变化计算.
解答:解:A、X=1.6,计算NO2和NO按照3;2混合,1mol混合物中NO2占
mol,根据①②化学方程式计算可知,消耗甲烷
mol;同理NO占
mol,消耗甲烷
mol,共计消耗甲烷
mol=0.25mol,故A错误;
B、利用盖斯定律,将题中反应
可得:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ?mol-1,气态水变为液态水是要放热,则
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l);△H<-867kJ?mol-1,故B错误;
C、若0.2molCH4还原NO2至N2,在上述条件下放出的热量为0.2mol×867kJ?mol-1=173.4kJ,故C错误;
D、若用标准状况下2.24LCH4还原NO2至N2,整个过程中转移的电子为
×[+4-(-4)]=0.8mol,故D正确;
故选D.
| 3 |
| 5 |
| 3 |
| 20 |
| 2 |
| 5 |
| 2 |
| 20 |
| 5 |
| 20 |
B、利用盖斯定律,将题中反应
| ①+② |
| 2 |
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ?mol-1,气态水变为液态水是要放热,则
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l);△H<-867kJ?mol-1,故B错误;
C、若0.2molCH4还原NO2至N2,在上述条件下放出的热量为0.2mol×867kJ?mol-1=173.4kJ,故C错误;
D、若用标准状况下2.24LCH4还原NO2至N2,整个过程中转移的电子为
| 2.24L |
| 22.4L/mol |
故选D.
点评:本题考查化学反应热的计算以及氧化还原反应等知识,题目难度不大,注意水的状态不同,放出的热量不同,掌握利用盖斯定律计算反应热的方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
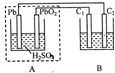 (2010?江西模拟)该图装置中,A为铅蓄电池,C1、C2为石墨电极,B烧杯中是浓度均为0.1mol/L的H2SO3和KI的混合溶液100mL.下列说法正确的是( )
(2010?江西模拟)该图装置中,A为铅蓄电池,C1、C2为石墨电极,B烧杯中是浓度均为0.1mol/L的H2SO3和KI的混合溶液100mL.下列说法正确的是( )